题目内容
一定温度下,分别往容积均为5 L的甲(恒压容器)、乙(恒容容器)中加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到达2 s时,测得乙容器中N2O4 的浓度为0.09 mol·L -1。经过60 s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)??
(1)容器中气体出现红棕色的原因(用化学方程表示)是___________________。?
(2)前2 s内乙容器中以N2O4的浓度变化表示的反应速率为_____________________。
(3)达到平衡时,甲容器中反应所需要的时间______________60 s(填“大于”“小于”或“等于”);反应过程中吸收的能量甲_____________(填“大于”“小于”或“等于”)乙。
(4)若要使甲、乙中N2O4浓度相等,不能采取的措施是_____________(填选项的标号)。
A.保持温度不变,适当压缩甲容器体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
(1)N2O4===2NO2 ?
(2)0.005 mol·L -1·s-1?
(3)大于 大于?
(4)B
解析:(1)N2O4部分分解 N2O4===2NO2。?
(2)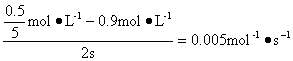
(3)甲始终恒压,(低积增大)反应慢,进行的程度大,时间长,吸收能量多,而乙恒容,压强增大,反应快,进行程度小,时间短,吸收能量少。?
(4)升温时平衡正移,N2O4浓度进一步减小。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)