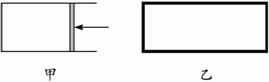题目内容
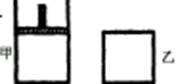
一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol·L -1。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。
(1)容器中气体出现红棕色的原因(用化学方程式表示)是__________________________。
(2)前2 s内,乙容器中以N2O4的浓度变化表示的反应速率为____________。
(3)达到平衡时,甲容器中反应所需的时间__________60 s(填“大于”“小于”或“等于”,以下同);两容器中都达到平衡时,N2O4的浓度甲______乙;反应过程中吸收的能量甲______乙。?
(4)两容器都达到平衡后,若要使甲、乙中N2O4浓度相等,不能采取的措施是_________。
A.保持温度不变,适当压缩甲容器体积?
B.保持容器体积不变,使甲容器升温?
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
(1)N2O4![]() 2NO2?
2NO2?
(2)0.005 mol·L -1·s -1?
(3)大于 小于 大于?
(4)B?
解析:(1)N2O4部分转化为NO2。N2O4![]() 2NO2?
2NO2?
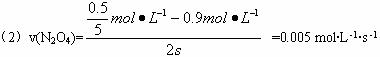
(3)a.甲容器始终维持一定的压强,而乙容器压强变大,故乙中反应快。甲反应慢,达到平衡时间长,反应进行程度大,吸收的能量多,但由于体积增大,故N2O4浓度小于乙。?
b.甲、乙达平衡后,将乙容积扩大到与甲相等,则平衡正移,故反应程度加大,吸收能量增加。

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
 如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)