题目内容
如图1,用惰性电极电解由四种都为元素周期表原子序数前10号元素组成的A溶液,在两电极区域分别得到B、C、D、E四种气体.它们之间在一定条件下反应流程如图2所示.其中F、D中原子核外电子总数相等,E是常见的导致温室效应的气体.常温下,在F中先通足量E气体,再通足量D气体,生成一种与A元素组成相同的物质G.上述反应流程没有其他物质参与.
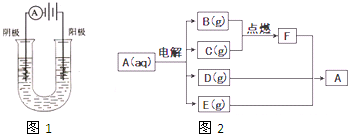
(1)写出G中的化学键类型 ,E的电子式 .
(2)写出上述反应流程中生成A的离子反应方程式 .
(3)写出D在纯净C中燃烧的化学反应方程式 .
(4)通常情况下,D极易溶于F中,其原因① ;② .
(5)往G的饱和溶液中通入E也能制得A,写出该反应的化学方程式 .
(6)写出该题中电解A溶液反应的总离子方程式 .

(1)写出G中的化学键类型
(2)写出上述反应流程中生成A的离子反应方程式
(3)写出D在纯净C中燃烧的化学反应方程式
(4)通常情况下,D极易溶于F中,其原因①
(5)往G的饱和溶液中通入E也能制得A,写出该反应的化学方程式
(6)写出该题中电解A溶液反应的总离子方程式
考点:无机物的推断,原电池和电解池的工作原理
专题:电化学专题
分析:用惰性电极电解由四种都为元素周期表原子序数前10号元素组成的A溶液,在两电极区域分别得到B、C、D、E四种气体,E是常见的导致温室效应的气体,则E是CO2,电解A能生成二氧化碳,说明电解过程中有氢离子生成,A为碳酸盐或碳酸氢盐,B和C能燃烧生成F,两种气体为氢气、氧气,阴极附近生成的氢氧根离子和铵根离子能反应生成氨气,F、D中原子核外电子总数相等,则D是NH3,常温下,在F中先通足量E气体,再通足量D气体,生成一种与A元素组成相同的物质G,则G是(NH4)2CO3,所以A是NH4HCO3,D能在C中燃烧则,C是O2、B是H2,再结合题目分析解答.
解答:
解:用惰性电极电解由四种都为元素周期表原子序数前10号元素组成的A溶液,在两电极区域分别得到B、C、D、E四种气体,E是常见的导致温室效应的气体,则E是CO2,电解A能生成二氧化碳,说明电解过程中有氢离子生成,A为碳酸盐或碳酸氢盐,B和C能燃烧生成F,两种气体为氢气、氧气,阴极附近生成的氢氧根离子和铵根离子能反应生成氨气,F、D中原子核外电子总数相等,则D是NH3,常温下,在F中先通足量E气体,再通足量D气体,生成一种与A元素组成相同的物质G,则G是(NH4)2CO3,所以A是NH4HCO3,D能在C中燃烧则,C是O2、B是H2,
(1)G是(NH4)2CO3,碳酸根离子和铵根离子之间存在离子键、铵根离子中N原子和H原子之间存在共价键、碳酸根离子中C原子和O原子之间存在共价键,所以碳酸铵中的化学键类型为离子键和共价键,E是二氧化碳,二氧化碳的电子式 ,故答案为:离子键和共价键;
,故答案为:离子键和共价键; ;
;
(2)二氧化碳、氨气和水以1:1:1反应生成碳酸氢铵,则生成A的离子反应方程式CO2+NH3+H2O=NH4++HCO3-,故答案为:CO2+NH3+H2O=NH4++HCO3-;
(3)D在纯净C中燃烧生成氮气和水,化学反应方程式4NH3+3O2
2N2+6H2O,
故答案为:4NH3+3O2
2N2+6H2O;
(4)通常情况下,D极易溶于F中,氨气和水反应生成一水合氨,氨气分子和水分子之间能形成氢键,导致氨气的溶解性大,故答案为:氨气和水反应;氨气分子和水分子形成分子间氢键;
(5)碳酸铵、二氧化碳和水反应生成碳酸氢铵,该反应的化学方程式为(NH4)2CO3+CO2+NH3=2NH4HCO3,故答案为:(NH4)2CO3+CO2+NH3=2NH4HCO3;
(6)电解A溶液生成氨气、氢气、氧气和二氧化碳,离子方程式为2NH4++2HCO3-
2H2↑+O2↑+2NH3↑+2CO2↑,故答案为:2NH4++2HCO3-
2H2↑+O2↑+2NH3↑+2CO2↑.
(1)G是(NH4)2CO3,碳酸根离子和铵根离子之间存在离子键、铵根离子中N原子和H原子之间存在共价键、碳酸根离子中C原子和O原子之间存在共价键,所以碳酸铵中的化学键类型为离子键和共价键,E是二氧化碳,二氧化碳的电子式
 ,故答案为:离子键和共价键;
,故答案为:离子键和共价键; ;
;(2)二氧化碳、氨气和水以1:1:1反应生成碳酸氢铵,则生成A的离子反应方程式CO2+NH3+H2O=NH4++HCO3-,故答案为:CO2+NH3+H2O=NH4++HCO3-;
(3)D在纯净C中燃烧生成氮气和水,化学反应方程式4NH3+3O2
| ||
故答案为:4NH3+3O2
| ||
(4)通常情况下,D极易溶于F中,氨气和水反应生成一水合氨,氨气分子和水分子之间能形成氢键,导致氨气的溶解性大,故答案为:氨气和水反应;氨气分子和水分子形成分子间氢键;
(5)碳酸铵、二氧化碳和水反应生成碳酸氢铵,该反应的化学方程式为(NH4)2CO3+CO2+NH3=2NH4HCO3,故答案为:(NH4)2CO3+CO2+NH3=2NH4HCO3;
(6)电解A溶液生成氨气、氢气、氧气和二氧化碳,离子方程式为2NH4++2HCO3-
| ||
| ||
点评:本题以电解原理为载体考查了无机物推断,一般电解质溶液电解时最多生成两种气体,该题电解时生成四种气体,很多同学往往漏掉溶液中电极附近存在的氢离子、氢氧根离子能分别和弱酸根离子、铵根离子反应而导致错误,难度中等.

练习册系列答案
相关题目
不能通过一次反应直接实现变化的是( )
①N2→NO2 ②S→SO2 ③NH3→NO ④NO→HNO3 ⑤HNO3→NO.
①N2→NO2 ②S→SO2 ③NH3→NO ④NO→HNO3 ⑤HNO3→NO.
| A、①⑤ | B、②⑤ | C、①④ | D、③④ |
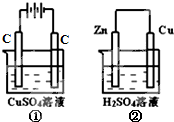 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化.下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化.下列叙述正确的是( )| A、产生气体体积:①=② |
| B、溶液的pH变化:①②均减小 |
| C、电极反应式:①中阳极为4OH--4e-═2H2O+O2↑,②中负极为2H++2e-═H2↑ |
| D、①中阴极质量增加,②中正极质量不变 |


 Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH, 【化学-选修5:有机化学基础】
【化学-选修5:有机化学基础】