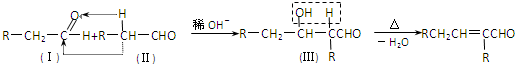题目内容
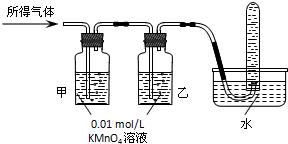
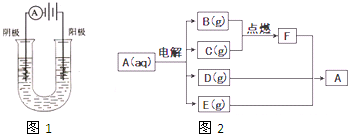
某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.当乙池中C极质量减轻10.8g时,回答下列问题.

(1)写出A极的电极方程式: .
(2)甲池中B电极理论上消耗O2的体积(标准状况下)为多少毫升?
(3)若丙池中溶液的体积为1000mL,此时丙池中溶液的pH为多少?

(1)写出A极的电极方程式:
(2)甲池中B电极理论上消耗O2的体积(标准状况下)为多少毫升?
(3)若丙池中溶液的体积为1000mL,此时丙池中溶液的pH为多少?
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子发生氧化反应;
(2)根据串联电路中转移电子相等计算;
(3)根据串联电路中转移电子相等计算出电解是生成的氢离子的浓度,再求pH.
(2)根据串联电路中转移电子相等计算;
(3)根据串联电路中转移电子相等计算出电解是生成的氢离子的浓度,再求pH.
解答:
解:(1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(2)C极上的电极反应为:Ag-e-═Ag+,B电极上的电极反应为:O2+2H2O+4e-═4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.025mol,体积为0.025mol×22.4L/mol=0.056L=56mL,
答:甲池中B电极理论上消耗O2的体积(标准状况下)为56ml;
(3)当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时丙池中E电极反应为2H2O-4e-═O2↑+4H+,所以生成的氢离子的物质的量0.1mol,则氢离子的浓度为
0.1mol/L,所以PH=1;
答:此时丙池中溶液的pH为1.
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(2)C极上的电极反应为:Ag-e-═Ag+,B电极上的电极反应为:O2+2H2O+4e-═4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.025mol,体积为0.025mol×22.4L/mol=0.056L=56mL,
答:甲池中B电极理论上消耗O2的体积(标准状况下)为56ml;
(3)当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时丙池中E电极反应为2H2O-4e-═O2↑+4H+,所以生成的氢离子的物质的量0.1mol,则氢离子的浓度为
0.1mol/L,所以PH=1;
答:此时丙池中溶液的pH为1.
点评:本题考查了原电池和电解池原理,正确判断原电池和电解池是解本题关键,根据离子的放电顺序、串联电路中转移电子相等来分析解答,难度中等.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列除杂的方法合理可行的是( )
| A、将混合气体通过灼热的氧化铜除去N2中混有的O2 |
| B、通入足量的CO2可除去NaHCO3溶液中混有的Na2CO3 |
| C、加入浓溴水,再过滤可以除去苯中混有少量的苯酚 |
| D、KNO3溶液中混有少量K2SO4可以通过加入适量BaCl2溶液并过滤来提纯 |
钛被誉为“21世纪金属”.工业冶炼钛的第一部反应为:TiO2+2C+2Cl2→TiCl4+2CO.下列关于该反应的说法正确的是( )
| A、TiO2是氧化剂 |
| B、氧化剂与还原剂的物质的量之比为1:1 |
| C、Cl2发生氧化反应 |
| D、当2mol C参加反应时,转移电子数目为2mol |