题目内容
 Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,回答下列问题:
(1)用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是
a.
| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |
(2)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是
a.反应所需要的时间E>A b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E d.E溶液里有镁粉剩余
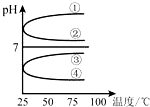
(3)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解),溶液pH随温度变化如图中
(4)室温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
Ⅱ、下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | T1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
(3)FeCl3的水溶液呈
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:Ⅰ、(1)加入水后氨水被稀释,一水合氨的电离程度增大,但是溶液中氢氧根浓度减小,氨水浓度减小,氢离子浓度增大,据此进行解答;
(2)A为氯化氢,属于强电解质,E为醋酸,属于弱电解质,醋酸在溶液中部分电离,则pH相同时,醋酸浓度大于氯化氢,开始时溶液中氢离子浓度相同,则反应速率相等,之后醋酸的电离程度增大,醋酸中氢离子浓度大于氯化氢,反应速率较大,优先结束反应,据此进行判断;
(3)将等体积、等物质的量浓度B和C混合后,溶质为硫酸铵溶液,溶液显示酸性,升高温度铵根离子水解程度增大,溶液酸性增强,据此进行解答;
(4)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,再滴加少许NaOH呈中性;
Ⅱ、(1)根据水的电离过程为吸热反应判断;
(2)根据硫酸钠的化学式组成判断c(Na+):c(SO42- ),根据常温下氢离子浓度计算c(Na+):c(OH-);根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性,t2℃时pH=6为中性,则此时溶液的pH小于6;为了防止其水解,在配制氯化铁溶液时常将FeCl3固体先溶于氯化氢中.
(2)A为氯化氢,属于强电解质,E为醋酸,属于弱电解质,醋酸在溶液中部分电离,则pH相同时,醋酸浓度大于氯化氢,开始时溶液中氢离子浓度相同,则反应速率相等,之后醋酸的电离程度增大,醋酸中氢离子浓度大于氯化氢,反应速率较大,优先结束反应,据此进行判断;
(3)将等体积、等物质的量浓度B和C混合后,溶质为硫酸铵溶液,溶液显示酸性,升高温度铵根离子水解程度增大,溶液酸性增强,据此进行解答;
(4)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,再滴加少许NaOH呈中性;
Ⅱ、(1)根据水的电离过程为吸热反应判断;
(2)根据硫酸钠的化学式组成判断c(Na+):c(SO42- ),根据常温下氢离子浓度计算c(Na+):c(OH-);根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性,t2℃时pH=6为中性,则此时溶液的pH小于6;为了防止其水解,在配制氯化铁溶液时常将FeCl3固体先溶于氯化氢中.
解答:
解:(1)a.B为NH3?H2O,由于加水稀释后,氨水电离程度增大,n(NH3?H2O)减小,n(OH-)增大,故
减小,故a正确;
b.氨水释后,溶液中c(OH-)减小,水的离子积不变,c(H+)增大,故
增大,故b错误;
c.温度不变,c(H+)和c(OH-)的乘积不变,故c错误;
d.氨水稀释后,氨水的电离程度增大,但是溶液中氢氧根离子浓度减小,故d正确;
故答案为:ad;
(2)pH相同的等体积的两份溶液HCl和CH3COOH,开始时c(H+)相同,反应速率相同,B错误;反应开始后,醋酸继续电离,c(H+)增大,反应速率大,反应生成等量氢气时所用时间少,A错误;PH相同等体积则CH3COOH的浓度大,物质的量多,完全反应消耗的锌粉多,所用醋酸中不可能剩余锌粉,d错误;生成等量的氢气,根据方程式知消耗的锌粉相同,c正确;
故答案为:c
(3)等体积、等物质的量浓度B硫酸氢钠和C氢氧化钠混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,溶液的pH减小,③错误、④正确,
故答案为:④
(4)NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
Ⅱ、(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大,
故答案为:>;升高温度,水的电离程度增大,离子积增大;
(2)硫酸钠溶液中一定满足c(Na+):c(SO42- )=2:1;硫酸钠溶液中c(Na+)=2×5×10-4 mol?L-1=10-3mol?L-1
稀释后溶液中钠离子浓度为:c(Na+)=
=10-4mol?L-1,溶液呈中性,c(OH-)=1×10-7 mol?L-1,
则c(Na+):c(OH-)=1×10-4 mol?L-1:1×10-7 mol?L-1=1000:1;
中25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4mol?L-1,得V(NaOH):V(H2SO4)=10:1,
故答案为:1000:1;10:1;
(3)FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性,t2℃时pH=6水的离子积为:1×10-12,pH=6时溶液为中性,则此时溶液的pH<6;
氯化铁水解的离子反应方程式为:Fe3++3H2O?Fe(OH)3+3H+,根据方程式知,为防止铁离子水解,在配制氯化铁溶液时常将FeCl3固体先溶于稀盐酸中,氢离子浓度增大,从而抑制铁离子水解,
故答案为:酸性;<;Fe3++3H2O?Fe(OH)3+3H+;HCl;抑制.
| c(B) |
| c(OH-) |
b.氨水释后,溶液中c(OH-)减小,水的离子积不变,c(H+)增大,故
| c(H+) |
| c(OH-) |
c.温度不变,c(H+)和c(OH-)的乘积不变,故c错误;
d.氨水稀释后,氨水的电离程度增大,但是溶液中氢氧根离子浓度减小,故d正确;
故答案为:ad;
(2)pH相同的等体积的两份溶液HCl和CH3COOH,开始时c(H+)相同,反应速率相同,B错误;反应开始后,醋酸继续电离,c(H+)增大,反应速率大,反应生成等量氢气时所用时间少,A错误;PH相同等体积则CH3COOH的浓度大,物质的量多,完全反应消耗的锌粉多,所用醋酸中不可能剩余锌粉,d错误;生成等量的氢气,根据方程式知消耗的锌粉相同,c正确;
故答案为:c
(3)等体积、等物质的量浓度B硫酸氢钠和C氢氧化钠混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,溶液的pH减小,③错误、④正确,
故答案为:④
(4)NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
Ⅱ、(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大,
故答案为:>;升高温度,水的电离程度增大,离子积增大;
(2)硫酸钠溶液中一定满足c(Na+):c(SO42- )=2:1;硫酸钠溶液中c(Na+)=2×5×10-4 mol?L-1=10-3mol?L-1
稀释后溶液中钠离子浓度为:c(Na+)=
| 10-3 |
| 10 |
则c(Na+):c(OH-)=1×10-4 mol?L-1:1×10-7 mol?L-1=1000:1;
中25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4mol?L-1,得V(NaOH):V(H2SO4)=10:1,
故答案为:1000:1;10:1;
(3)FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性,t2℃时pH=6水的离子积为:1×10-12,pH=6时溶液为中性,则此时溶液的pH<6;
氯化铁水解的离子反应方程式为:Fe3++3H2O?Fe(OH)3+3H+,根据方程式知,为防止铁离子水解,在配制氯化铁溶液时常将FeCl3固体先溶于稀盐酸中,氢离子浓度增大,从而抑制铁离子水解,
故答案为:酸性;<;Fe3++3H2O?Fe(OH)3+3H+;HCl;抑制.
点评:本题考查了弱电解质电离平衡及其影响因素、盐的水解及其应用方法、酸碱混合的定性判断及有关溶液pH的简单计算,题目难度中等,试题题量较大,知识点较多,注意掌握盐的水解原理及其应用方法,明确弱电解质的电离平衡及其影响因素.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组物质中,前者属于电解质,后者属于非电解质的是( )
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、使石蕊变红色的溶液:Fe2+、K+、SO42-、NO3- |
| B、使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C、0.1mol?L-1 AgNO3溶液:H+、K+、SO42-、I- |
| D、0.1mol?L-1 Na2CO3溶液:OH-、Na+、Cl-、SO42- |
 科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有
科学家发现C60分子由60个碳原子构成,它的形状像足球(图丙),含有 键,因此又叫足球烯.1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图.图中小黑点均代表碳原子.
键,因此又叫足球烯.1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图丁),图甲、图乙分别是金刚石和石墨的结构示意图.图中小黑点均代表碳原子. (1)足量镁粉与一定量的盐酸反应,能产生一定量的氢气.由于反应太快,不易操作.为减慢反应速率,但不影响H2的总量,可以加入下列物质中的
(1)足量镁粉与一定量的盐酸反应,能产生一定量的氢气.由于反应太快,不易操作.为减慢反应速率,但不影响H2的总量,可以加入下列物质中的