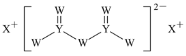
题目内容
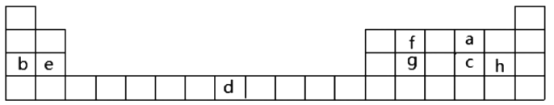
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。回答问题:
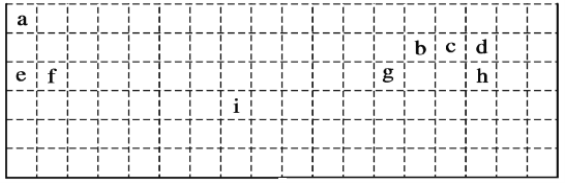
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。并注明金属非金属的分界线___。
(2)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为___(填元素符号)。
(3)实验室制ca3的化学反应方程式为___。
(4)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为___。
(5)设计实验验证b、c非金属性的强弱,用离子方程式表示为___。
(6)i在周期表中的位置为___。i对应的单质与水反应的化学方程式为___。
(7)a2d2的电子式为___;用电子式表示fCl2的形成过程___。
(8)分别由a、d、e、h四种元素形成的两种盐反应的离子方程式为___。
【答案】 H Ca(OH)2+2NH4Cl
H Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑ Al2O3+2OH-=2AlO2-+H2O CO32-+2H+=CO2↑+H2O 第四周期第Ⅷ族 3Fe+4H2O(g)
CaCl2+2H2O+2NH3↑ Al2O3+2OH-=2AlO2-+H2O CO32-+2H+=CO2↑+H2O 第四周期第Ⅷ族 3Fe+4H2O(g)![]() Fe3O4+4H2↑
Fe3O4+4H2↑ ![]()
![]() H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
【解析】
(1)用实线是元素周期表的部分边界,用红线表示金属与非金属的分界线为: ;
;
(2)第ⅦA族元素容易得一个电子,显-1价,而H也可以显-1价,如在NaH中H的化合价为-1,应该是H;
(3)c为N,a为H,则ca3是NH3,实验室制法:Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(4)g是Al,则其氧化物为Al2O3,e是Na,其最高价氧化物对应水化物为NaOH,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
(5)b是C、c是N,比较非金属性的强弱,可比较最高价氧化物对应水化物酸性,酸性:HNO3>H2CO3,离子方程式为:CO32-+2H+=CO2↑+H2O;
(6)i为铁,为于第四周期第Ⅷ族,与水的反应为:3Fe+4H2O(g)![]() Fe3O4+4H2↑;
Fe3O4+4H2↑;
(7)b是O,则a2d2是H2O2,双氧水为共价化合物,分子中存在两个H-O键和一个O-O键,电子式为![]() ;f是Mg,fCl2是MgCl2,用电子式表示MgCl2的形成过程为:
;f是Mg,fCl2是MgCl2,用电子式表示MgCl2的形成过程为:![]() ;
;
(8)分别由a、d、e、h四种元素形成的两种盐分别是NaHSO3、NaHSO4,反应的离子方程式为:H++HSO3-=H2O+SO2↑。

 阅读快车系列答案
阅读快车系列答案