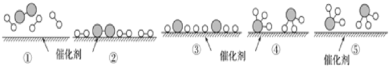
题目内容
【题目】X、Y、Z、W、M均为短周期元素,M的一种核素不含中子,X、Y、Z、W在周期表中的位置如图所示,Y原子最外层电子数为内层电子数的3倍。下列说法不正确的是
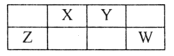
A. 原子半径:Z>X>Y>M
B. X、Y、Z、W与M均能形成18电子分子
C. X、Y、M形成的化合物水溶液一定呈酸性
D. Y的简单阴离子还原性弱于X的简单阴离子还原性
【答案】C
【解析】
X、Y、Z、W、M均为短周期元素,M的一种核素不含中子,则M是H元素,Y原子最外层电子数为内层电子数的3倍,则Y是O元素,根据元素的相对位置各种X是N元素,Z是Si元素,W是Cl元素,据此分析解答。
综上所述可知,X是N元素,Y是O元素,Z是Si元素,W是Cl元素,M是H元素。
A.同一周期的元素,原子序数越大,原子半径越小;原子核外电子层数越多,原子半径越大,M原子核外只有1层,X、Y核外有2个电子层;Z、W核外有3个电子层,所以原子半径Z>X>Y>M,A正确;
B. X、Y、Z、W分别是N、O、Si、Cl,M是H,这些元素与H形成的18电子的分子分别是N2H4、H2O2、SiH4、HCl,B正确;
C.X、Y、M形成的化合物如HNO3、HNO2、NH4NO3水溶液呈酸性,而NH3H2O显碱性,C错误;
D.元素的非金属性越强,其简单阴离子的还原性就越弱,由于元素的非金属性Y>X,所以Y的简单阴离子还原性弱于X的简单阴离子还原性,D正确;
故合理选项是C。

 阅读快车系列答案
阅读快车系列答案【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
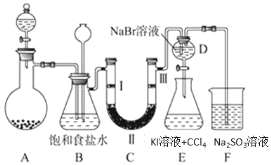
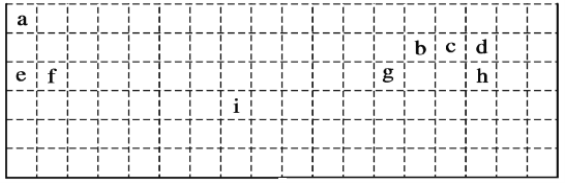
(1)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放______
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量的氯气时,可以看到无色溶液逐渐变为橙黄色,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是下层溶液呈紫色,则证明了溴单质的氧化性强于碘单质,但是有同学对该结论提出异议,可能理由是___________。
(3)烧杯F中的 亚硫酸钠溶液用来吸收尾气,设计实验方案验证尾气吸收后溶液中含有 SO42-_____。