题目内容
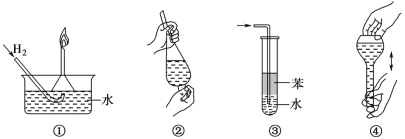
【题目】一学生用如图装置研究原电池原理,下列说法错误的是( )
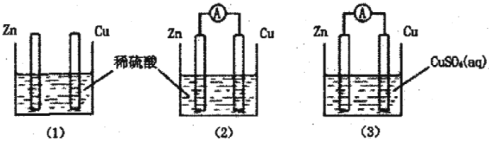
A.(2)图中电子由Zn沿导线流向Cu
B.(3)图中Zn片增重质量与Cu棒减轻质量比值为65∶64
C.(1)图中铜棒上没有气体产生
D.(2)图与(3)图中正极生成物质量比为1∶32时,Zn片减轻的质量相等
【答案】B
【解析】
A.(2)图是原电池,活泼金属锌是负极,铜是正极,所以电子由Zn沿导线流向Cu,故A正确;
B.(3)图是原电池装置,锌做负极失电子生成锌离子,铜做正极,溶液中铜离子得到电子生成铜,锌电极减轻,铜电极增重,故B错误;
C.(1)图中锌和稀硫酸发生反应生成氢气,铜和稀硫酸不反应,(1)图中铜棒上没有气体产生,故C正确;
D.(2)图与(3)图中负极反应式为:Zn-2e-=Zn2+,(2)图中正极上电极反应2H++2e-=H2↑,(3)图中正极电极反应为Cu2++2e-=Cu,正极生成物质质量比为1:32时,两个原电池中电子转移相同,根据电子守恒,所以反应的锌的质量相同,故D正确;
故答案选B。

练习册系列答案
相关题目