题目内容
在温度相同,压强分别为p1、p2条件下,A(g)+2B(g) nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是
nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是
| A.p1 > p2 n < 3 | B.p1< p2 n > 3 |
| C.p1< p2n = 3 | D.p1 > p2n > 3 |
D
解析试题分析:分析题给图像知,压强为p1时达到平衡的时间短,反应速率快,结合压强对反应速率的影响规律知,p1 > p2,压强增大,C%的百分含量降低,从压强对平衡移动的影响分析,说明平衡向逆反应方向,则n>3,选D。
考点:考查化学平衡图像及外界条件对化学速率和平衡移动的影响。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )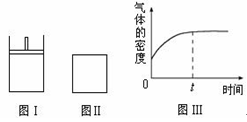
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
下列事实中不能用勒夏特列原理来解释的是
| A.向H2S水溶液中加入NaOH固体有利于S2-增多 |
| B.鼓入过量空气有利于SO2转化为SO3 |
| C.高压对合成氨有利 |
| D.500 ℃左右比室温更有利于氨的合成 |
在容积可变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g) ΔH<0,某研究小组研究了其他条件不变时,只改变某一条件对上述反应的影响,下列分析正确的是( )
| A.图Ⅰ表示的是t1时刻升高温度对反应速率的影响 |
| B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
工业上可利用合成气(CO和H2的混合气体)生产甲醇。已知:
CO(g)+2H2(g) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1
一定条件下,该反应在一体积固定的密闭容器中达到平衡。下列说法正确的是
| A.该反应的△S<0 |
| B.该反应在任何温度下均能自发进行 |
| C.向容器中充入少量He,平衡向正反应方向移动 |
| D.升高温度平衡向正反应方向移动 |
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:



