题目内容
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2 2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
| A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0375mol·L-1·min-1 |
| B.保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
| C.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用右图表示 |
| D.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
C
解析试题分析:A、(t-BuNO)2的转化量为1.0×75%=0.75mol,ν(t-BuNO)=2(t-BuNO)2=2×0.75÷2÷10=0.075mol·L-1·min-1,错误;B、体系中加入不反应的气体,反应物浓度不变,平衡不移动,错误;C、升高温度,反应物转化率增大平衡正向移动,反应吸热,正确;D、在正庚烷k=(1.5/2)2÷0.25/2=4.5大于在CCl4中平衡常数,平衡逆向移动,转化率减小,错误。
考点:考查化学平衡移动有关问题。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=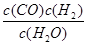 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为______________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |

(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
铝的以下反应得以进行的原因,可用勒沙特勒原理解释的是
| A.与盐酸反应产生氢气 |
| B.在氯气中燃烧 |
| C.放入硝酸汞溶液中表面形成铝汞齐 |
| D.一定温度下,用铝与氧化钙反应制得金属钙 |
20 ℃ 时,将0.1 mol/L Na2S2O3溶液10mL 和 0.1 mol/L H2SO4溶液10mL混合,2 min 后溶液出现明显浑浊(发生的反应为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)。已知温度每升高10 ℃ ,该反应的化学反应速率增大到原来的2倍。那么50 ℃时,同样的反应要明显地出现浑浊,所需时间是
| A.48s | B.40s | C.20s | D.15s |
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是 1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
汽车尾气净化中的一个反应如下:
在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
| A.达到平衡后,若只升高温度,化学平衡正向移动 |
| B.达到平衡后,再通人稀有气体,逆反应速率增大 |
| C.使用催化剂,平衡常数不变 |
| D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1 |
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:
2NO(g)+2CO(g) N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4 mol·L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
经分析,得出结论不正确的是
A.2~3 s间的平均反应速率v(NO)=9×10-5 mol/(L·s)
B.催化转化器对废气的转化速率在夏季时比冬季时高
C.若该催化转化器气舱容积为2 L,则达到平衡时反应放出热量1.8a J
D.该温度下,此反应的平衡常数K=5000
 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法: