题目内容
13.下列有关元素的性质及其递变规律叙述正确的是( )| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质不一定相同 | |
| C. | 第三周期中,除稀有气体元素外原子半径最大的是氯 | |
| D. | 同主族元素氢化物的稳定性越强其沸点就越高 |
分析 A.卤素元素形成的单质熔沸点自上而下逐渐升高,而碱金属元素形成的单质熔沸点自上而下逐渐降低;
B.核外电子排布相同的微粒可能为分子或离子;
C.第三周期中,原子序数大的原子半径小;
D.稳定性与非金属性有关,沸点与氢键、相对分子质量有关.
解答 解:A.卤素元素形成的单质熔沸点自上而下逐渐升高,而碱金属元素形成的单质熔沸点自上而下逐渐降低,与单质的类别、化学键等有关,故A错误;
B.核外电子排布相同的微粒可能为分子或离子,如水与铵根离子性质不同,故B正确;
C.第三周期中,原子序数大的原子半径小,则第三周期中,除稀有气体元素外原子半径最大的是Na,故C错误;
D.稳定性与非金属性有关,沸点与氢键、相对分子质量有关,卤素中HF最稳定且沸点最大,但第ⅣA中甲烷最稳定沸点最低,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
3.下列各组顺序的排列不正确的是( )
| A. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 | B. | 热稳定性:HF>HCl>H2S>PH3 | ||
| C. | 微粒半径:Na+>Mg2+>Al3+>F- | D. | 熔点:SiO2>NaCl>I2>CO2 |
4.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成64 g SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 在此反应中,浓硫酸表现出酸性和氧化性 |
8.下列关于如图所示装置的说法,正确的是( )
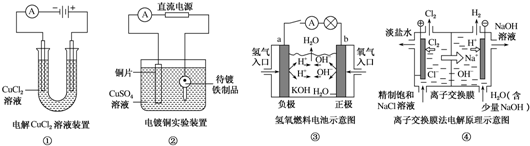

| A. | ①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝 | |
| B. | ②装置中待镀铁制品应与电源正极相连 | |
| C. | ③装置中电子由b极流向a极 | |
| D. | ④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
18.下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ).
根据上述数据回答(1)~(4)题:
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?能.你的根据是生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定.
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?能.你的根据是生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定.


 .
. ;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl. 某化学兴趣小组利用如图装置验证元素非金属性的变化规律.
某化学兴趣小组利用如图装置验证元素非金属性的变化规律.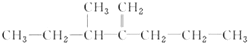 ,此烃名称为3-甲基-2-丙基-1-戊烯.
,此烃名称为3-甲基-2-丙基-1-戊烯.