题目内容
3.下列各组顺序的排列不正确的是( )| A. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 | B. | 热稳定性:HF>HCl>H2S>PH3 | ||
| C. | 微粒半径:Na+>Mg2+>Al3+>F- | D. | 熔点:SiO2>NaCl>I2>CO2 |
分析 A.元素的金属性越强,对应的对应最高价氧化物的水化物的碱性越强;
B.元素的非金属性越强,对应的氢化物越稳定;
C.核外电子排布相同的离子,核电荷数越大离子半径越小;
D.晶体熔点一般为原子晶体>离子晶体>分子晶体.
解答 解:A.同一周期,从左到右,元素的金属性逐渐减弱,金属性Na>Mg>Al,元素的金属性越强,对应的对应最高价氧化物的水化物的碱性越强,故A正确;
B.非金属性F>Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,则热稳定性HF>HCl>H2S>PH3,故B正确;
C.Na+、Mg2+、Al3+、F-具有相同的核外电子排布,核外电子排布相同的离子,核电荷数越大离子半径越小,故C错误;
D.SiO2为原子晶体,NaCl为离子晶体,I2、CO2为分子晶体,碘常温下为固体,沸点比二氧化碳大,故D正确.
故选C.
点评 本题考查元素周期表和元素周期律,熟悉金属性、非金属性的比较方法及氢键对物质熔沸点的影响是解答本题的关键,难度不大,注意规律性知识的总结.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
13.下列说法不正确的是( )
| A. | 最外层电子数为次外层电子数一半的短周期主族元素只有Li、Si两种元素 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素 | |
| C. | 同周期第ⅡA族与第ⅢA族元素的原子序数相差1或11或25 | |
| D. | 若主族元素的族序数为a,周期数为b,当$\frac{a}{b}$<1,该元素为非金属元素 |
14.下列有关化学用语表示正确的是( )
| A. | -CHO的电子式: | B. | 丙烷分子的比例模型为: | ||
| C. | 顺-1,2-二溴乙烯结构式为: | D. | 1,4-二甲苯的结构简式为: |
15.在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是( )
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO.
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO.
| A. | ①③④ | B. | ③⑦ | C. | ③⑤ | D. | ⑥ |
12.关于化学反应与能量的说法正确的是( )
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 断裂化学键要放出能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
13.下列有关元素的性质及其递变规律叙述正确的是( )
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质不一定相同 | |
| C. | 第三周期中,除稀有气体元素外原子半径最大的是氯 | |
| D. | 同主族元素氢化物的稳定性越强其沸点就越高 |
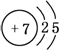
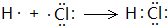
 .
. ;(B)
;(B)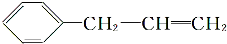 .
.