题目内容
5.如图为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题: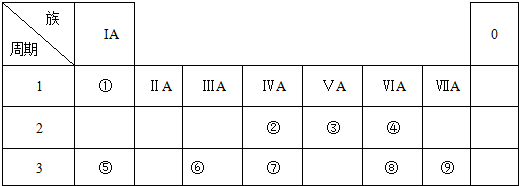
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.
(2)⑦的原子结构示意图为
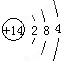 .
.(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO4.
(4)写出③形成的单质的结构式:N≡N;⑧和⑨可形成四原子化合物A,A中各原子均满足稳定结构.写出A的电子式
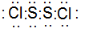 ;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.(5)⑥的最高价氧化物的水化物与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 依据元素周期表可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)Si有3个电子层,最外层电子数为4;
(3)元素的非金属性越强,对应的高价氧化物对应水化物的酸性越强;
(4)③为N,其形成的单质为氮气,氮气中存在三对共价键;S和Cl形成的均满足8个电子的稳定结构的四原子化合物为:S2Cl2,水解生成二氧化硫气体;
(5)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸,据此书写离子反应方程式即可.
解答 解:依据元素周期表可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,故答案为:Na>Al>O;
(2)⑦为Si,对应的离子核外有3个电子层,最外层电子数为4,原子结构示意图为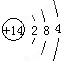 ,故答案为:
,故答案为: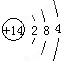 ;
;
(3)②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3,③为N,非金属N>C,元素的非金属性越强,对应的高价氧化物对应水化物的酸性越强,所以酸性:HNO3>H2CO3,故答案为:HNO3>H2CO3>H2SiO4;
(4)氮气中存在三对共价键,结构式为:N≡N;S和Cl可形成四原子化合物A是:S2Cl2,S2Cl2中各原子均满足稳定结构,那么S2Cl2的电子式为: ,S2Cl2与水反应生成刺激性气味且能使品红溶液褪色的气体,该气体为二氧化硫,化学反应方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故答案为:N≡N;
,S2Cl2与水反应生成刺激性气味且能使品红溶液褪色的气体,该气体为二氧化硫,化学反应方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故答案为:N≡N; ;2S2Cl2+2H2O=SO2↑+3S↓+4HCl;
;2S2Cl2+2H2O=SO2↑+3S↓+4HCl;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素的推断,题目难度不大,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握电子式的书写.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO.
| A. | ①③④ | B. | ③⑦ | C. | ③⑤ | D. | ⑥ |
| A. | 0 | B. | 175 | C. | 57 | D. | 118 |
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质不一定相同 | |
| C. | 第三周期中,除稀有气体元素外原子半径最大的是氯 | |
| D. | 同主族元素氢化物的稳定性越强其沸点就越高 |
| A. | 原子半径:Li>Na | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数相同 | D. | 核外电子数相同 |
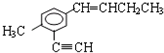 中,同一平面上碳原子最多数目和同一直线上的碳原子最多数目分别为( )
中,同一平面上碳原子最多数目和同一直线上的碳原子最多数目分别为( )| A. | 11、4 | B. | 10、3 | C. | 12、4 | D. | 13、4 |
| A. | 燃烧反应 | B. | 加聚反应 | C. | 消去反应 | D. | 取代反应 |