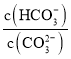题目内容
【题目】电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。
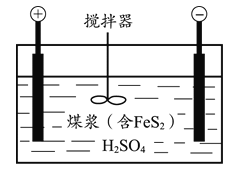
(1)将煤打成煤浆加入电解槽的目的是________。
(2)阳极的电极反应式为________。
(3)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:FeS2 +·OH =Fe3+ + SO42- + H2O +___。
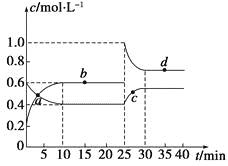
(4)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如下图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;________。
【答案】增大接触面积,提高反应速率(或使反应更充分) H2O – e-=·OH + H+(或OH-– e-=·OH) 1 FeS2 + 15·OH=1Fe3+ + 2SO42- + 7 H2O +1___H+___ pH升高,促进Fe3+水解生成Fe(OH)3,覆盖在煤浆表面,阻止反应进行
【解析】
(1)将煤打成煤浆可以增大接触面积;
(2)阳极水得电子产生了羟基自由基;
(3)根据得失电子守恒、电荷守恒配平用羟基自由基除去煤中二硫化亚铁(FeS2)的离子方程式;
(4)根据铁元素易水解回答;
(1)将煤打成煤浆可以增大接触面积,提高反应速率,使反应更充分;
(2)阳极水得电子产生了羟基自由基,阳极反应式是H2O – e-=·OH + H+;
(3)FeS2 中S元素化合价由-1升高为+6、Fe元素化合价由+2升高为+3,·OH 中氧元素化合价由-1降低为-2,根据得失电子守恒、电荷守恒,反应的离子方程式是1 FeS2 + 15·OH=1Fe3+ + 2SO42- + 7 H2O +H+;
(4)pH升高,促进Fe3+水解生成Fe(OH)3,覆盖在煤浆表面,阻止反应进行。

【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(2) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为__________。
(3) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(4) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。