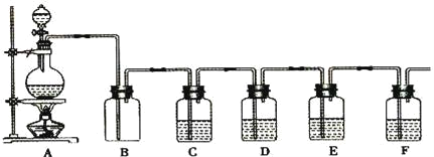
题目内容
【题目】高温下,某可逆反应达到平衡,其平衡常数为K= ![]() ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
A.该反应的化学方程式为CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.升高温度,K值减小
C.升高温度,逆反应速率减小
D.该反应的焓变为正值
【答案】D
【解析】
A、该反应的方程式为CO2(g)+H2(g) ![]() CO(g)+H2O(g),选项A错误;
CO(g)+H2O(g),选项A错误;
B、升高温度,H2的浓度减小,平衡向正反应方向进行,K值增大,选项B错误;
C、升高温度,正、逆反应速率均增大,选项C错误;
D、高温下,某可逆反应达到平衡,其平衡常数为K=![]() ,则该反应的方程式为CO2(g)+H2(g)
,则该反应的方程式为CO2(g)+H2(g) ![]() CO(g)+H2O(g),恒容时,升高温度,H2的浓度减小,说明平衡向正反应方向进行,因此正反应是吸热反应,即该反应的焓变为正值,选项D正确;
CO(g)+H2O(g),恒容时,升高温度,H2的浓度减小,说明平衡向正反应方向进行,因此正反应是吸热反应,即该反应的焓变为正值,选项D正确;
答案选D。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向苯酚钠溶液中滴加NaHSO3溶液,溶液变浑浊 | 苯酚酸性弱于H2SO3酸性 |
B | 向AgNO3溶液中逐滴加入浓度均为0.05 mol·L-1的NaI、NaCl混合溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3溶液中加入Cu粉,Cu粉溶解 | Cu的还原性大于Fe |
D | 向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现 | 铁离子催化H2O2的分解 |
A.AB.BC.CD.D