题目内容
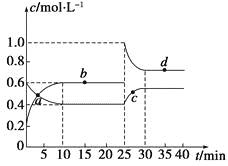
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是___________________________。
【答案】增大 bd 0.04 mol·L-1·min-1 0.8 mol NO2 小于 假设平衡时二氧化氮的浓度为0.8 mol·L-1,则此时Q=1.28>K=0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1
【解析】
(1)该反应为吸热反应,所以温度升高,K值增大,答案为增大;
(2)由图可知,10~25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态;由图可知从起点开始首次达到平衡时,以NO2表示的反应速率为(0.6-0.2)mol/L÷10min=0.04 mol·L-1·min-1;
(3)25min时,c(NO2)瞬间增大,比平衡状态增加了(1-0.6)mol/L×2L=0.8mol,增大c(NO2),平衡向生成N2O4方向移动;
(4)若平衡时二氧化氮的浓度为0.8 mol·L-1,则平衡时四氧化二氮的浓度是0.5mol/L,则此时Q=![]() =1.28>K=
=1.28>K=![]() =0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1 。
=0.9,平衡要逆向移动,使二氧化氮的浓度降低,所以平衡时二氧化氮的浓度小于0.8 mol·L-1 。