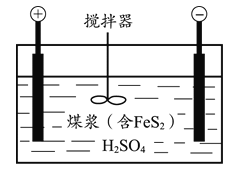
题目内容
【题目】Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是( )
HCO3-+OH-。下列说法错误的是( )
A.加水稀释,溶液中所有离子的浓度都减小B.通入CO2,溶液pH减小
C.加入NaOH固体,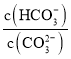 减小D.升高温度,平衡常数增大
减小D.升高温度,平衡常数增大
【答案】A
【解析】
A.碳酸钠溶液显碱性,其中加水稀释时,溶液中OH-离子浓度减小,由于溶液中存在水的离子积常数,所以溶液中c(H+)增大,A错误;
B.通入CO2,其与水反应生成碳酸,碳酸与碳酸根离子反应产生HCO3-,溶液中HCO3-的水解程度小于CO32-的水解程度。向碱性的溶液中加入酸,溶液的碱性一定会减弱,故溶液pH减小,B正确;
C.加入NaOH固体会抑制碳酸钠水解,所以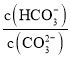 减小,C正确;
减小,C正确;
D.温度升高,促进盐的水解,因此水解平衡常数增大,D正确;
故合理选项是A。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目