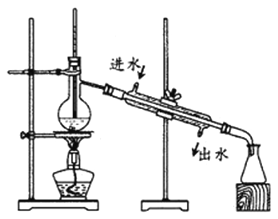
题目内容
【题目】已知:①298 K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq) ΔH<0
H+(aq)+F-(aq) ΔH<0
根据以上已知信息判断下列说法正确的是( )
A. 298 K时,加蒸馏水稀释HF溶液,![]() 保持不变
保持不变
B. 308 K时,HF的电离常数Ka>3.5×10-4
C. 298 K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq) K≈0.68
CaF2(s)+2H+(aq) K≈0.68
【答案】D
【解析】A. 加水稀释,平衡右移,c(HF)减少的程度大,c(F-)减少程度小, ![]() 增大,A错误;B.升高温度,平衡左移,电离常数减少,B错误;C. Ksp只受温度的影响,温度不变,Ksp不变,C错误;D.该反应的K=c2(H+)/c(Ca2+)c2(HF), 分子分母同时乘以 c2(F-)就会得到 K =K2(HF)/ Ksp(CaF2)= (3.5×10-4)2/1.8×10-7,近似计算为K≈0.68,D正确;答案选D。
增大,A错误;B.升高温度,平衡左移,电离常数减少,B错误;C. Ksp只受温度的影响,温度不变,Ksp不变,C错误;D.该反应的K=c2(H+)/c(Ca2+)c2(HF), 分子分母同时乘以 c2(F-)就会得到 K =K2(HF)/ Ksp(CaF2)= (3.5×10-4)2/1.8×10-7,近似计算为K≈0.68,D正确;答案选D。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目