题目内容
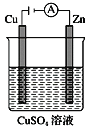
【题目】如图,铁片、铜片和CuSO4溶液可以构成原电池或电解池,下列说法正确的是( )

A. 构成原电池时,Cu极反应式为Cu-2e-=Cu2+
B. 构成电解池时,Cu极质量可能减少也可能增加
C. 构成电解池时,Fe极质量一定减少
D. 构成的原电池或电解池在工作时的反应原理一定不同
【答案】B
【解析】A.铁的活泼性大于铜,构成原电池时,铁做负极,铜做正极;Cu极反应式为Cu2++2e-= Cu,A错误;B. 构成电解池时,Cu极做阳极,不断溶解,质量减少;Cu做阴极时,有金属在电极上析出,电极质量增加;B正确;C. 构成电解池时,Fe极做阴极,质量可能不变,也可能增加;C错误;D. 原电池或电解池在工作时的反应原理都是在两极发生了氧化还原反应;D错误;答案选D。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】钛与铁是很重要的金属。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为__________________,金属钛晶胞如下左图所示,晶胞参数为a=b= 295.08pm,c=468.55pm,α=β=90%,y= 120%。金属钛为______________堆积(填堆积方式)。
(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为____________晶 体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因:_______________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如下右图所示。晶体的化学式为_________________。
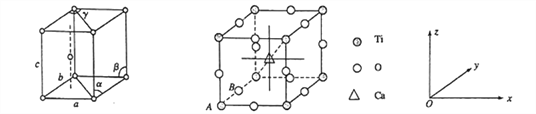
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca 离子的原子坐标为______________。
(5)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
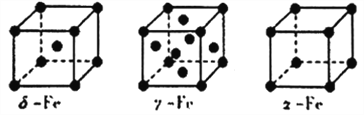
①δ、α两种晶体晶胞中铁原子的配位数之比为_______________________。
②若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为________g/cm3(列出算式即可)。
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ