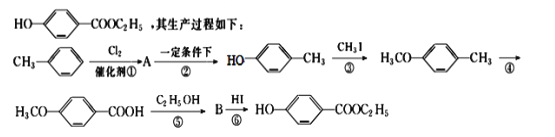
��Ŀ����
����Ŀ����(Sb)���仯�����ڹ�ҵ����������;���Ի������Ҫ�ɷ�ΪSb2S3��������PbS��As2S3��CuO��SiO2�ȣ�Ϊԭ���Ʊ�������Ĺ���������ͼ��ʾ��
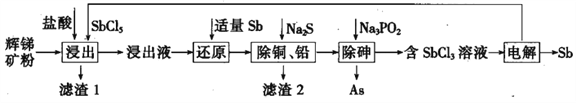
��֪���� ����Һ�г������������SbCl5֮�⣬������SbCl3��PbCl2��AsCl3��CuCl2�ȣ�
�ڳ����£�Ksp(CuS)=1.27��10-36��Ksp(PbS)=9.04��10-29��
����Һ������Ũ��С�ڵ���1.0��10-5mol��L-1ʱ����Ϊ�����ӳ�����ȫ��
��1������1�г���S֮�⣬����___________���ѧʽ����
��2����������ʱ��Sb2S3������Ӧ�Ļ�ѧ����ʽΪ_________________��
��3������ԭ��ʱ����Sb��ԭ������Ϊ_____________���ѧʽ����
��4�������£�����ͭ��Ǧ��ʱ��Cu2+��Pb2+��������ȫ����ʱ��Һ�е�c(S2-)������______������Na2SҲ���˹��࣬��ԭ��Ϊ_____________��
��5�������顱ʱ��H3PO3���ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ________________��
��6������⡱ʱ����������SbԪ���뱻��ԭ��SbԪ�ص�����֮��Ϊ_______��
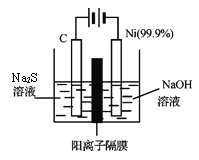
��7��һ��ͻ�ƴ�ͳ�����������þ-��Һ̬�������ܵ�ع���ԭ����ͼ��ʾ��

�õ�������ܶȵIJ�ͬ�������������·�Ϊ���㣬����ʱ�м�������ε���ɲ��䡣���ʱ��C1-��_____����ϡ����¡����ƶ����ŵ�ʱ�������ĵ缫��ӦʽΪ________��
���𰸡� SiO2 Sb2S3��3SbCl5��5SbCl3��3S SbCl5 9.04��10-24 mol��L��1 ����H2S����Ⱦ�����������Sb2S3 2AsCl3��3Na3PO2��3HCl��3H2O��2As��3H3PO3��9NaCl 3�U2 �� Mg2����2e����Mg
��������(1)��������Ҫ�ɷ�ΪSb2S3��������PbS��As2S3��CuO��SiO2��)���ڼ��������SbCl5���ݽ���Һ�г������������SbCl5֮�⣬������SbCl3��PbCl2��AsCl3��CuCl2����Sb2S3��PbS��As2S3��CuO�����ܽ⣬ֻ��SiO2���ܣ�����1�г���S֮�⣬���ж������裬�ʴ�Ϊ��SiO2��
(2)��������ʱ��Sb2S3��SbCl5����������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪSb2S3��3SbCl5��5SbCl3��3S ���ʴ�Ϊ��Sb2S3��3SbCl5��5SbCl3��3S ��
(3)��������ͼ�ͣ������к�������SbCl5����������ԭ���Ȳ�����õ�SbCl3�����SbCl5��Sb��ԭ���ʴ�Ϊ��SbCl5��
(4)���ݳ����£�Ksp(CuS)=1.27��10-36��Ksp(PbS)=9.04��10-29����Cu2+��Pb2+��������ȫʱ��c(S2-)�ֱ���![]() =1.27��10-31 mol/L��
=1.27��10-31 mol/L��![]() =9.04��10-24 mol/L�����c(S2-)������9.04��10-24 mol/L�������������ܹ���Һ�е��ᷴӦ�ų���Ⱦ���������⣬���������ƻ�����SbCl3���ɳ������������Na2SҲ���˹��࣬�ʴ�Ϊ��9.04��10-24 mol/L������H2S����Ⱦ�����������Sb2S3��
=9.04��10-24 mol/L�����c(S2-)������9.04��10-24 mol/L�������������ܹ���Һ�е��ᷴӦ�ų���Ⱦ���������⣬���������ƻ�����SbCl3���ɳ������������Na2SҲ���˹��࣬�ʴ�Ϊ��9.04��10-24 mol/L������H2S����Ⱦ�����������Sb2S3��
(5)��������ʱ��������As�⣬����H3PO3���ɣ���Ӧ�Ļ�ѧ����ʽΪ2AsCl3��3Na3PO2��3HCl��3H2O��2As��3H3PO3��9NaCl���ʴ�Ϊ��2AsCl3��3Na3PO2��3HCl��3H2O��2As��3H3PO3��9NaCl��
(6)��������ͼ���������ʱ��SbCl3��Ӧ����SbCl5��Sb�����ݻ��ϼ������غ㣬��������SbԪ���뱻��ԭ��SbԪ�ص����ʵ���֮��Ϊ3:2������֮��Ϊ3:2���ʴ�Ϊ��3:2��
(7)�м��������Ϊ�������Һ�����ݵ�������þҺΪ��صĸ��������ʱ��þ��Ϊ�������������������ƶ����������ƶ����ŵ�ʱ��þҺΪ��صĸ������缫��ӦΪMg -2e��=Mg2��������������ԭ��Ӧ���缫��ӦʽΪMg2����2e����Mg���ʴ�Ϊ���£�Mg2����2e����Mg��

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪����
��2NO+Na2O2=2NaNO2
��2NO2+Na2O2=2NaNO3
������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4������ԭ��Mn2+��
��Ʒ�Ʊ�����飺��ͼ20װ���Ʊ�NaNO2
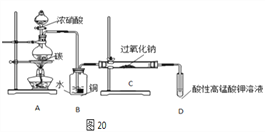
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ________________��
��2��Bװ�õ�������___________��ʢŨ�������������Ϊ__________��
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ�����̼���ƺ��������ƣ�Ϊ�Ʊ�������NaNO2��Ӧ��B��Cװ�ü�����һ������ܡ��ڸ������ʢ�ŵ��Լ�����Ϊ____________��
��4�������ʵ�飬����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_________��
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
KMnO4��Һ���/mL | 20.60 | 20.02 | 20.00 | 19.98 |
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ����������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������_______��
����Ŀ��ijͬѧ����480 mL 0.5 mol/L NaOH��Һ��
�� ��ͬѧ��ʵ������У��õ��IJ��������У���Ͳ������������ͷ�ι�___________��
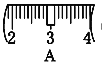
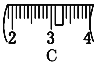
�� �������������ͼ��ʾ�����ͼ����Ӧ����ͼ�е�____(��ѡ����ĸ)֮�䡣
A������� B������� C������� D�������


�� ��ͬѧӦ��ȡNaOH����___g��������Ϊ23.1 g���ձ�����������ƽ�ϳ�ȡ����NaOH����ʱ�����ڸ�����ѡȡ����������С_____(��Сд��ĸ)��
������ͼ��ѡ������ȷ��ʾ����λ�õ�ѡ��____(���д��ĸ)��
������������
a | b | c | d | e | |
�����С/g | 100 | 50 | 20 | 10 | 5 |

�� ��ͬѧʵ������NaOH��Һ��Ũ��Ϊ0.48 mol��L��1��ԭ�������____(�����)��
A������NaOH����ʱ�������ˡ�������� B������ƿ��ԭ����������ˮ
C���ܽ������ձ���Һ��δϴ�� D���ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶�