题目内容
【题目】下列物质中,属于共价化合物的是( )
A.CO2B.NH4ClC.CaCl2D.NaCl
【答案】A
【解析】
A.二氧化碳分子中碳原子和氧原子之间只含共价键,属于共价化合物,选项A正确;
B.氯化铵中铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在共价键,属于离子化合物,选项B错误;
C.氯化钙中钙离子和氯离子之间只含离子键,属于离子化合物,选项C错误;
D.氯化钠中钠离子和氯离子之间只含离子键,属于离子化合物,选项D错误;
答案选A。

【题目】钛与铁是很重要的金属。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为__________________,金属钛晶胞如下左图所示,晶胞参数为a=b= 295.08pm,c=468.55pm,α=β=90%,y= 120%。金属钛为______________堆积(填堆积方式)。
(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为____________晶 体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因:_______________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如下右图所示。晶体的化学式为_________________。
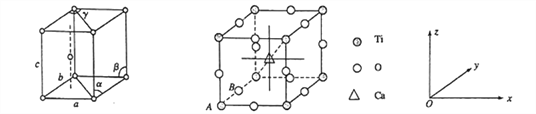
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca 离子的原子坐标为______________。
(5)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
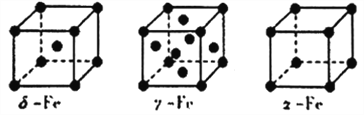
①δ、α两种晶体晶胞中铁原子的配位数之比为_______________________。
②若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为________g/cm3(列出算式即可)。