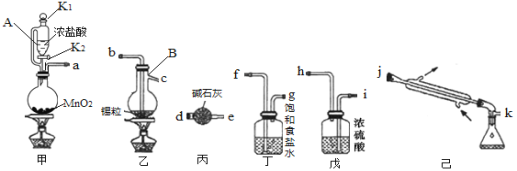
题目内容
【题目】丙烯是一种重要的有机化工原料,用于制丙烯腈、环氧丙烷、丙酮等。回答下列问题:
(1)已知:
I.C3H8(g)![]() C3H6(g)+H2(g) △H1=+124kJ/mol
C3H6(g)+H2(g) △H1=+124kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
则丙烷氧化脱氢制丙烯反应2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g)的△H为_________kJ/mol。
2C3H6(g)+2H2O(g)的△H为_________kJ/mol。
(2)我国学者结合实验与计算机模拟结果,研究了丙烷在六方氮化硼催化剂表面氧化脱氢制丙烯的反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
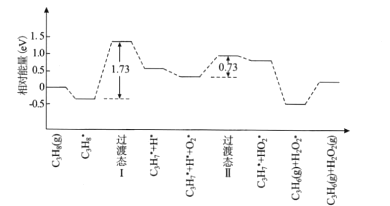
①该反应历程中决速步骤的能垒(活化能)为_________eV,该步骤的化学方程式为________
②请补充该历程之后可能发生的化学反应方程式_____________
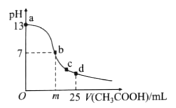
(3)已知丙烷氧化脱氢容易发生副反应:2C3H8(g)+O2(g)![]() 3C2H4(g)+2H2O(g)如图所示是丙烷氧化脱氢制丙烯反应达到平衡时丙烷转化率与丙烯选择性随温度变化的曲线[丙烯的选择性=n=
3C2H4(g)+2H2O(g)如图所示是丙烷氧化脱氢制丙烯反应达到平衡时丙烷转化率与丙烯选择性随温度变化的曲线[丙烯的选择性=n=![]() ×100%]
×100%]
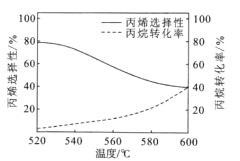
①丙烯的选择性随着温度的升高而降低的可能原因有_________
②在反应温度为600℃,将C3H8与O2以体积比为1:1充入刚性容器中,达到平衡时,丙烷的转化率为40%,丙烯的选择性也为40%,体系总压强为pkPa,则氧气的转化率![]() (O2)=______________丙烯的分压p(C3H8)=____________(结果保留2位有效数字)。
(O2)=______________丙烯的分压p(C3H8)=____________(结果保留2位有效数字)。
【答案】-236 1.73 C3H8=C3H7+H 2H2O2=2H2O+O2↑ 升高温度,催化剂的活性降低,生成丙烯的反应平衡逆向移动,生成乙烯的副反应产物参加 20% 0.087pkPa
【解析】
(1) 根据盖斯定律计算反应热;
(2)①该反应历程中决速的步骤为慢反应,活化能越大,反应速率越慢;根据活化能确定该步骤的化学方程式;
②该历程产物为双氧水,不稳定易分解,之后可能发生双氧水分解;
(3)①反应2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g)为吸热反应,温度过高催化剂活性降低;
2C3H6(g)+2H2O(g)为吸热反应,温度过高催化剂活性降低;
②根据图示,结合“三段式”计算。
(1)已知:I.C3H8(g)![]() C3H6(g)+H2(g) △H1=+124kJ/mol
C3H6(g)+H2(g) △H1=+124kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
根据盖斯定律,I×2+ II可得:2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) △H=-236kJ/mol;
2C3H6(g)+2H2O(g) △H=-236kJ/mol;
(2)①该反应历程中决速的步骤为慢反应,活化能越大,反应速率越慢,根据图示,活化能最大的为过渡态I,能垒(活化能)为1.73 eV;根据活化能确定该步骤的化学方程式为C3H8=C3H7+H;
②该历程产物为双氧水,不稳定易分解,之后可能发生双氧水分解,反应为:2H2O2=2H2O+O2↑;
(3)①反应2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g)为吸热反应,温度过高催化剂活性降低,则升高温度,催化剂的活性降低,生成丙烯的反应平衡逆向移动,生成乙烯的副反应产物参加;
2C3H6(g)+2H2O(g)为吸热反应,温度过高催化剂活性降低,则升高温度,催化剂的活性降低,生成丙烯的反应平衡逆向移动,生成乙烯的副反应产物参加;
②根据图示在反应温度为600℃,将C3H8与O2以体积比为1:1充入刚性容器中,达到平衡时,丙烷的转化率为40%,丙烯的选择性也为40%,体系总压强为pkPa,相同条件下,物质的量之比等于体积之比,2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g)和2C3H8(g)+O2(g)
2C3H6(g)+2H2O(g)和2C3H8(g)+O2(g)![]() 3C2H4(g)+2H2O(g),反应中C3H8与O2的反应比例关系相同,设C3H8与O2的起始物质的量为1mol,则:
3C2H4(g)+2H2O(g),反应中C3H8与O2的反应比例关系相同,设C3H8与O2的起始物质的量为1mol,则:
![]()
则氧气的转化率![]() (O2)=
(O2)=![]() ×100%=20%;
×100%=20%;
设平衡时,反应生成C3H6的物质的量为x,生成C2H4的物质的量为y,
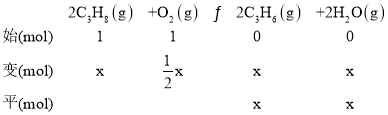
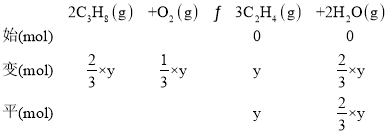
根据题意可得: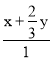 ×100%=40%,
×100%=40%,![]() 40%,解得:x=0.2mol,y=0.3mol,平衡时n(C3H8)=1mol×(1-40%)=0.6mol,n(O2)=1mol×(1-20%)=0.8mol,n(H2O)=0.2mol+
40%,解得:x=0.2mol,y=0.3mol,平衡时n(C3H8)=1mol×(1-40%)=0.6mol,n(O2)=1mol×(1-20%)=0.8mol,n(H2O)=0.2mol+![]() ×0.3mol=0.4mol,丙烯的分压p(C3H8)= pkPa×
×0.3mol=0.4mol,丙烯的分压p(C3H8)= pkPa×![]() =0.087pkPa。
=0.087pkPa。

【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)若配制250 mL H2SO4溶液,则需量筒量取密度为1.84 g·cm-3,质量分数为98%的浓硫酸____mL。
Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:
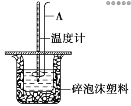
(2)仪器A的名称为___________。
(3)写出表示该反应中和热的热化学方程式:__________________。
(4)取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。
实验 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差的平均值为____
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=___________(取小数点后一位)。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)碎泡沫塑料的作用是___________。