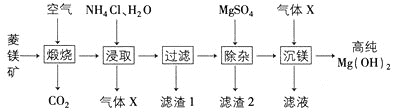
题目内容
【题目】亚硫酸钠容易被氧化,某化学兴趣小组为测定某亚硫酸钠样品的纯度,三名学生分别设计了不同实验方案。
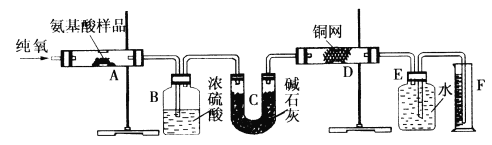
甲同学的实验方案:称取10.0g样品,进行如图所示实验,测得装置D中干燥管实验前后增大。

(1)写出B中发生反应的化学方程式___________________________________。装置E的作用是__________________。
乙同学的实验方案:称取10.0g样品,溶于过量的盐酸后,再加入过量的BaCl2溶液,过滤、洗涤、烘干,称量沉淀质量为0.9g。
(2)洗涤沉淀的方法是_____________________,重复2~3次。
丙同学的设计方案步骤如下:
①称取样品10.0g,加水溶解配成250 mL溶液;②量取25.00 mL待测溶液于锥形瓶中;
③用酸化的0.1502 mol·L —1 KMnO4标准液滴定至终点;
④重复操作2~3次,得出消耗KMnO4溶液体积的平均值为19.97 mL。
(3)滴定中盛装KMnO4标准液的仪器是_______________________________。
(4)写出滴定过程中发生反应的离子方程式:___________________________。
(5)确定滴定达到终点的操作及现象为_______________________________。
(6)三名学生通过实验数据计算出的样品纯度各不相同,指导教师指出__________(填“甲”、“乙”、“丙”)同学实验误差较大,其实验装置存在明显缺陷,理由是_________。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 防止空气中的CO2和水蒸气进入D中,影响实验结果 向漏斗中注入蒸馏水至恰好浸没沉淀,待水自然流下 酸式滴定管 5SO32-+2MnO4-+6H+===5SO42-+2Mn2++3H2O 滴入最后一滴KMnO4溶液,溶液由无色变成浅紫红色,且半分钟内不褪色 甲 反应结束后,装置中残留一定量的SO2(或SO2气流速度过快或装置气密性不好),未被装置D吸收
【解析】
长期存放的亚硫酸钠可能会被部分氧化生成硫酸钠,也就是说该样品中可能含亚硫酸钠和硫酸钠。甲同学设计的实验方案的原理为用70%硫酸与样品中亚硫酸钠反应生成二氧化硫,通过测定碱石灰吸收二氧化硫的量测定样品的纯度;乙同学设计的实验方案的原理为先将样品溶于过量的盐酸中除去样品中的亚硫酸钠,再加入过量的BaCl2溶液,过滤、洗涤、烘干,称量硫酸钡沉淀质量,利用硫酸钡沉淀质量测定样品的纯度;丙同学设计的实验方案的原理为利用亚硫酸钠具有还原性,用酸性高锰酸钾标准溶液滴定样品溶液,利用消耗酸性高锰酸钾溶液的量测定样品的纯度。
(1)B中发生的反应为70%硫酸与样品中亚硫酸钠反应生成硫酸钠、二氧化硫和水,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;因碱石灰能吸收空气中的CO2和水蒸气,会导致所测结果偏大,则装置E中碱石灰的作用是吸收空气中的CO2和水蒸气,防止CO2和水蒸气进入D中,影响实验结果,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;防止空气中的CO2和水蒸气进入D中,影响实验结果;
(2)乙同学最终得到是硫酸钡沉淀,洗涤沉淀的方法是向过滤器中注入蒸馏水至恰好浸没沉淀,待水自然流下后,重复2~3次,故答案为:向漏斗中注入蒸馏水至恰好浸没沉淀,待水自然流下;
(3)KMnO4具有强氧化性,会腐蚀碱式滴定管中的橡胶管,则滴定中, KMnO4标准液盛装在酸式滴定管中,故答案为:酸式滴定管;
(4)滴定过程中,酸性高锰酸钾溶液与亚硫酸钠发生氧化还原反应生成硫酸钠、硫酸钾、硫酸锰和水,反应的离子方程式为5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O,故答案为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O;
(5)当酸性高锰酸钾溶液过量时,溶液会变为紫色,则确定滴定达到终点的操作及现象为滴入最后一滴酸性高锰酸钾溶液,溶液由无色变成浅紫红色,且半分钟内不褪色,故答案为:滴入最后一滴KMnO4溶液,溶液由无色变成浅紫红色,且半分钟内不褪色;
(6)甲同学设计的实验存在缺陷,一是若装置气密性不好,二氧化硫泄露,导致测定结果偏低;二是二氧化硫气流速度过快,不能被D中碱石灰完全吸收,导致测定结果偏低;三是装置中残留二氧化硫,没有被D中碱石灰完全吸收,导致测定结果偏低,故答案为:甲;反应结束后,装置中残留一定量的SO2(或SO2气流速度过快或装置气密性不好),未被装置D吸收。

【题目】化合物X是一种环境激素,存在如下转化关系:
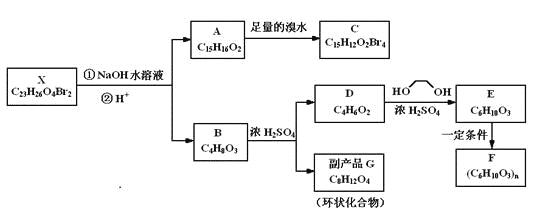
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H-NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题。
(1)下列叙述正确的是_________。
A.化合物A分子中含有联苯结构单元 |
B.化合物A可以和NaHCO3溶液反应,放出CO2气体 |
C.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH |
D.化合物D能与Br2发生加成反应 |
(2)化合物C的结构简式是_________________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构_________。
a.属于酯类 b.能发生银镜反应
(4)写出B→C反应的化学方程式_______________________________________________。
(5)写出E→F反应的化学方程式_______________________________________________。
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
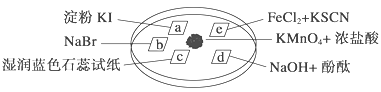
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
【题目】氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:
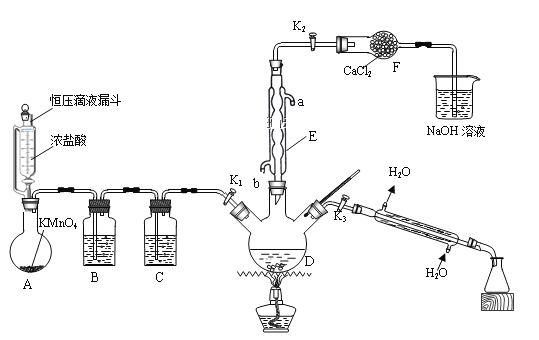
回答下列问题:
(1)仪器E的名称是_____________;其作用是_______________________________________。
(2)装置B中的溶液为___________________。
(3)用恒压滴液漏斗代替分液漏斗的优点是__________________________________________。
(4)装置A中反应的离子方程式为__________________________________________________。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 molL-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为_____%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是__________________________________________________。