题目内容
【题目】如图是全钒液流储能电池的示意图,a、b是碳电极,几种含钒元素的离子在水溶液中颜色如表所列,全钒液中还含有H+、SO42-,下列说法中错误的是

V2+ | V3+ | VO2+ | VO2+ |
紫色 | 绿色 | 蓝色 | 黄色 |
A.当外接负载时,右槽溶液若逐渐由紫变绿,则b为负极
B.当外接负载时,电流若由a流出,则左槽溶液的pH增大
C.当b与外接电源负极相连时,则b极发生V3++e—=V2+
D.充电时若电路中转移0.1 mol电子,则左槽溶液中n(H+)的变化量为0.2 mol
【答案】D
【解析】
A.当外接负载时,右槽溶液若逐渐由紫变绿,说明V2+失电子被氧化发生氧化反应生成V3+,则b为负极,故A正确;
B.当外接负载时,电流若由a流出,a为原电池的正极,VO2+在正极得电子发生还原反应生成VO2+,电极反应式为VO2++2H++e-═VO2++H2O,由电极反应式可知,放电时正极消耗氢离子,溶液的pH增大,故B正确;
C.当b与外接电源负极相连时,b为电解池阴极,V3+在阴极得电子发生还原反应生成V2+,电极反应式为V3++e—=V2+,故C正确;
D.充电时,左槽发生的反应为VO2++H2O—e-═VO2++2H+,当转移0.1 mol电子,生成氢离子为0.2mol,右槽发生的反应为V3++e—=V2+,电荷数变化为0.1 mol,则由电荷守恒可知,有0.1 mol氢离子由左槽移向右槽,左槽溶液中n(H+)的变化量为(0.2—0.1)mol=0.1mol,故D错误;
故选C。

 目标测试系列答案
目标测试系列答案【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】化合物X是一种环境激素,存在如下转化关系:
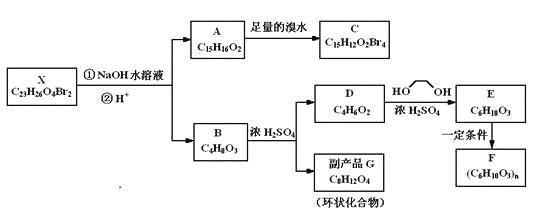
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H-NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题。
(1)下列叙述正确的是_________。
A.化合物A分子中含有联苯结构单元 |
B.化合物A可以和NaHCO3溶液反应,放出CO2气体 |
C.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH |
D.化合物D能与Br2发生加成反应 |
(2)化合物C的结构简式是_________________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构_________。
a.属于酯类 b.能发生银镜反应
(4)写出B→C反应的化学方程式_______________________________________________。
(5)写出E→F反应的化学方程式_______________________________________________。
【题目】I、“蓝天白云”是现代城市人向往的目标,而机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式: ____________
Ⅱ、一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X发生反应:
pX(g)Y(g)+Z(g)相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
A | 387 | 0.20 | 0.080 | 0.080 |
B | 387 | 0.40 | 0.160 | 0.160 |
C | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器A中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器A和容器B中起始时X的反应速率v(X)A___________v(X)B(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”)。
(3)容器B中X的平衡转化率为___________,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,则反应将向___________(填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________
Ⅲ、科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4下列关于该太电池的叙述错误的是____________
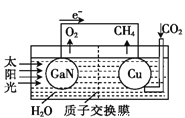
A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
