题目内容
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4-+ H+ Ka1; HC2O4-
HC2O4-+ H+ Ka1; HC2O4-![]() C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
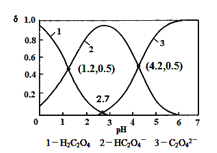
A.常温下,Ka1:Ka2=1000
B.将相同物质的量 KHC2O4和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液
C.pH=1.2溶液中:c(K +) + c(H +) = c(OH-) + c(H2C2O4)
D.向pH=1.2的溶液中加KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
【答案】B
【解析】
A.电离平衡常数Ka1=[H+][HC2O4-]/[H2C2O4]=10-1.2,Ka2=[H+][C2O42-]/[HC2O4-]=10-4.2,Ka1:Ka2=1000,A项正确;
B.pH=4.2时,[HC2O4-]、[C2O42-]的浓度相等,而相同物质的量 KHC2O4和 K2C2O4固体完全溶于水得到的溶液, HC2O4-和C2O42-的水解程度不同,离子浓度不再相等,B项错误;
C.pH=1.2溶液中,存在电荷守恒c(K +) + c(H +) = c(OH-) + c(HC2O4-),c(HC2O4-)=c(H2C2O4),则c(K +) + c(H +) = c(OH-) + c(H2C2O4),C项正确;
D.随着KOH溶液的加入,HC2O4-的浓度逐渐减少,C2O42-的浓度增大,而HC2O4-的水解程度小于C2O42-的水解程度,盐的水解促进水的电离,所以向 pH=1.2的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大,D项正确;
答案选B。

 阅读快车系列答案
阅读快车系列答案