题目内容
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了防止环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
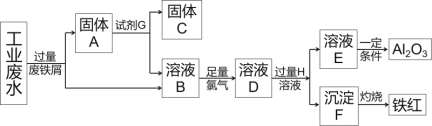
(1)固体A的成分是____(用化学式表示)。
(2)写出B→D的离子方程式____,该反应中氧化剂是____,2 mol Cl2参加反应转移电子数____,溶液D中滴加KSCN溶液的现象是____。
(3)D→E反应的离子方程式是____。
【答案】Fe、Cu 2Fe2+ + Cl2 =2Fe3+ + 2Cl- Cl2 4mol或4×6.02×1023 溶液呈血红色 Al3+ + 4OH- =![]() + 2H2O
+ 2H2O
【解析】
流程工业废水中含Fe3+、Al3+、Cu2+,加过量铁发生2Fe3++Fe═3Fe2+、Fe+Cu2+═Cu+2Fe2+,由于铁过量,过滤分离出固体A为Fe、Cu,溶液B含Al3+、Fe2+,固体A中加试剂为盐酸,过滤分离出固体C为Cu;溶液B中加足量氯气发生2Fe2++Cl2=2Fe3++2Cl-,溶液D中含Al3+、Fe3+,为分离Al3+、Fe3+,H为NaOH(或其它强碱),沉淀F为Fe(OH)3,灼烧F得到铁红;溶液E含NaAlO2,溶液E中通入足量的CO2得到Al(OH)3,过滤后加热Al(OH)3得到Al2O3。
(1)固体A的成分是Fe、Cu,故答案为:Fe、Cu;
(2)B→D的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,Cl元素的化合价降低,该反应中氧化剂是Cl2,2mol Cl2参加反应转移电子为2mol×2×(1-0)=4mol,或4×6.02×1023;因为溶液D中含Fe3+,溶液D中滴加KSCN溶液的现象是溶液呈血红色,故答案为:2Fe2++Cl2=2Fe3++2Cl-;Cl2;4mol或4×6.02×1023;溶液呈血红色;
(3)铝盐和过量的强碱反应生成偏铝酸盐和水,D→E反应的离子方程式是Al3+ + 4OH- =![]() + 2H2O,故答案为:Al3+ + 4OH- =
+ 2H2O,故答案为:Al3+ + 4OH- =![]() + 2H2O。
+ 2H2O。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案