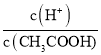题目内容
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式:
SO2(g)+NH3H2O(aq)=NH4HSO3(aq) △H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=____kJmol﹣1。
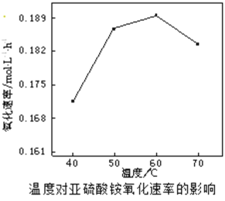
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是________。
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K=________.[已知Ksp(CaCO3)=2.9×10﹣9,Ksp(CaSO4)=9.1×10﹣6]
【答案】2a+2b+c 温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低) 3138
【解析】
(1)根据盖斯定律进行计算;
(2)根据图1分析,60℃氧化速率最快;温度过高(NH4)2SO3会分解(或水解),或溶液中的氧气的量减小;
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s),该反应的平衡常数
SO42-(aq)+CaCO3(s),该反应的平衡常数![]() ,带入数值进行计算。
,带入数值进行计算。
(1)①根据盖斯定律,给已知方程式编号
①SO2(g)+NH3·H2O(aq)═NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq) △H3=ckJ·mol-1;
反应①×2+②×2+③,可得2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l),则△H=△H1×2+△H2×2+△H3= (2a+2b+c)kJ·mol-1;
(2)根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,温度过高(NH4)2SO3会分解(或水解),浓度减小;或温度升高氧气在溶液中溶解度降低,造成氧化速率减慢;答案为:温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低);
(3)反应的离子方程式为CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s),该反应的平衡常数
SO42-(aq)+CaCO3(s),该反应的平衡常数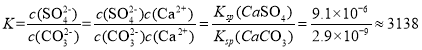 。
。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案