题目内容
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) = 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = kJ/mol
2NH3(g) ΔH = kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=(只需代入数据,不用计算结果)
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式: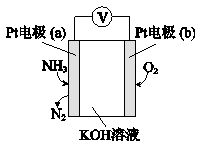
【答案】
(1)-92.2
(2)B,C
(3)0.82/(1.83×0.6);逆向
(4)4NH3 -12e- +12OH- =2N2+12H2O
【解析】(1)已知25℃时:①N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
②2H2(g) + O2(g) =2H2O(l) ΔH = -571.6 kJ/mol
③4NH3(g) + 5O2(g) =4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 根据盖斯定律①+②×3/2-1/2×③即得到N2(g) + 3H2(g) ![]() 2NH3(g) ΔH =-92.2kJ/mol;
2NH3(g) ΔH =-92.2kJ/mol;
(2)A.容器内N2、H2、NH3的浓度之比为1︰3︰2并不能说明正逆反应速率相等,则不一定达到平衡状态,A不符合题意;
B.3v(N2)正=v(H2)逆表示正逆反应速率相等,达到平衡状态,B符合题意;
C.正反应体积减小,容器内压强保持不变 说明反应达到平衡状态,C符合题意;
D.生成1mol N2的同时消耗2molNH3均表示逆反应速率,不能说明反应达到平衡状态,D不符合题意;
(3)①
N2(g) + | 3H2(g) | 2NH3(g) | |
起始(mol/L) | 1 | 3 | 0 |
转化(mol/L) | 0.4 | 1.2 | 0.8 |
平衡(mol/L) | 0.6 | 1.8 | 0.8 |
因为合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积,所以该反应的平衡常数表达式为K=c2(NH3) /c3(H2)c(N2)=0.82/(1.83×0.6);
②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应,起始时反应进行的方向为逆向;
(4)Pt电极通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原发生还原反应。负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3 -6e- +6OH-=N2+6H2O。
故答案为:(1)-92.2;(2)BC;(3)①0.82/(1.83×0.6);②逆向;(4)2NH3 -6e- +6OH-=N2+6H2O。
(1)根据盖斯定律计算目标反应的反应热;
(2)判断反应是否达到平衡状态,应分析所给选项条件是否体现“正逆反应速率相等”,若能体现正逆反应速率相等,则说明反应达到平衡状态;
(3)①根据三段式、平衡常数的表达式进行计算;
②结合等效平衡分析;
(4)由图可知a电极为负极,NH3发生失电子的氧化反应,转化为N2 , 结合溶液为碱性,书写电极反应式。