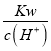题目内容
【题目】下列说法正确的是 ( )
A. HF的稳定性很强,是因为HF分子之间能形成氢键
B. 水结成冰时,H—O键的键长变长,密度减小
C. 含氢元素的化合物中一定有氢键
D. 能与水分子形在氢键的物质易溶于水
【答案】D
【解析】A. 氢键是一种较强的分子间作用力,主要影响物质的熔沸点、密度、溶解度等物理性质,而分子的稳定性由共价键的强弱决定,与氢键无关,故A错误;B. 冰中水分子之间以氢键结合形成疏松的晶体,空隙较大,使得冰的密度比水小,故B错误;C. 形成氢键要有电负性很大且原子半径较小的元素如N、O、F等,故C错误;D. 能与水分子形在氢键的物质易溶于水,故D正确。故选D。

【题目】下列化学用语表述正确的是( )
A. 核内质子数为117,核内中子数为174的核素Ts可表示为:174TS
B. 乙醇的结构简式:C2H6O
C. COCl2 的结构式为: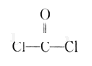
D. CaO2的电子式为:![]()
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183kJ/mol
2NO(g) ΔH = +183kJ/mol
2H2(g) + O2(g) = 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) = 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = kJ/mol
2NH3(g) ΔH = kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=(只需代入数据,不用计算结果)
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式: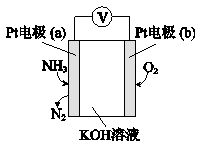
【题目】氧化亚铜(Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液(CuCl42-、Cl-、H+)和碱性蚀刻液[Cu(NH3)42+、NH4+、NH3、Cl-]来制备,工艺流程如下:
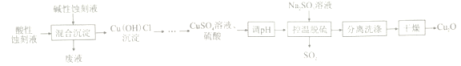
已知:强酸条件下,2Cu+==Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______左右。
pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
废液含铜量/g.L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17.0 |
(2)“混合沉淀”中废液的主要成分为______________(填化学式)
(3)“控温脱硫”生成Cu2O的离子方程式为_________;该过程产生的SO2经_____(填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:
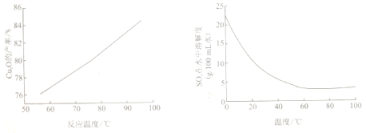
下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________。
(6)某工厂用V1,L含铜量120g·L-1的酸性蚀刻液和V2L含铜量160g·L-1的碱性蚀刻液制备Cu2O,最终得到产品mg,产率为____%。