��Ŀ����
����Ŀ��
�뼰�仯�����Ӧ�������汻���ӡ�
��l������Ҫ�ĺ������������ʯ����2������Cr��������ʯ��Ϊ��ĸ�̡���̬Crԭ�Ӽ۵��ӵĹ����ʾʽΪ__________��
��2�����������������Ԫ���������ơ������й��������������ȷ����_____�����ţ���
A��������p������Ԫ�� B���縺�Զ���þ��
C����һ�����ܶ���þ�� D.�Ȼ����ˮ��ҺpH��С��7
��3���롢�����嶼���ɽ���ԭ�����ò�����ά�ռ�ѻ����ɣ����ܶѻ���������۵�(155lK)�������۵�(930K)�ߣ�ԭ����______________��
��4���Ȼ�������̬ʱ����BeC12���ӣ�a���Ͷ��۷��ӣ�BeCl2)2(b)����̬ʱ���������ͼ��ʾ����״�ṹ��c����

�� a����__________����������Ǽ����������ӡ�
�� b��Beԭ�ӵ��ӻ���ʽ��ͬ��������ԭ�Ӷ���ͬһƽ���ϡ�b �ĽṹʽΪ____ �������λ������
�� c��Beԭ�ӵ��ӻ���ʽΪ__________��
�� �Ȼ��뾧���д��ڵ���������__________�����ţ���
A�����»��� B. �Ҽ� C.���Լ� D���Ǽ��Լ� E�����Ӽ�
��5��BeO������������ͼ��ʾ��

�� BeO�����У�O2-����λ��Ϊ___________��
�� ��BeO������ܶ�Ϊdg/cm3��������a =______nm ���г�����ʽ���ɣ���
���𰸡� ![]() B��D Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ �Ǽ���
B��D Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ �Ǽ��� 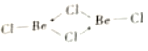 sp3 A��B��C 4
sp3 A��B��C 4 ![]()
����������l��Cr����������24�����ݺ�������Ų����ɿ�֪��̬Crԭ�Ӽ۵��ӵĹ����ʾʽΪ![]() ����2��A��Be����s������Ԫ�أ�A����B�������Զ�����þ����˵縺�Զ���þ��B��ȷ��C��Mg��3s�������ȫ����������һ�����ܱ�����C����D.�Ȼ�������ˮ��ˮ�⣬��Һ�����ԣ�ˮ��ҺpH��С��7��D��ȷ����3��Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ���������۵�(155lK)�������۵�(930K)�ߡ���4����BeC12������ֱ���νṹ�����ڷǼ��Է��ӡ��� ��ԭ���ṩ�¶Ե��ӣ����b�ĽṹʽΪ
����2��A��Be����s������Ԫ�أ�A����B�������Զ�����þ����˵縺�Զ���þ��B��ȷ��C��Mg��3s�������ȫ����������һ�����ܱ�����C����D.�Ȼ�������ˮ��ˮ�⣬��Һ�����ԣ�ˮ��ҺpH��С��7��D��ȷ����3��Beԭ�Ӱ뾶��Alԭ�Ӱ뾶С����������ǿ���������۵�(155lK)�������۵�(930K)�ߡ���4����BeC12������ֱ���νṹ�����ڷǼ��Է��ӡ��� ��ԭ���ṩ�¶Ե��ӣ����b�ĽṹʽΪ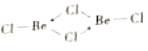 ����c��Beԭ�ӵļ۲���Ӷ�����4���ӻ���ʽΪsp3�����Ȼ��뾧���д��ڵ��������з��»������Ҽ������Լ�����ѡA��B��C����5���ٸ���BeO����Ľṹ���ж�O2-����λ��Ϊ4���ھ�������ԭ�Ӹ�����8��1/8+6��1/2=4��Beԭ�Ӹ�����4����BeO������ܶ�Ϊdg/cm3��������a=
����c��Beԭ�ӵļ۲���Ӷ�����4���ӻ���ʽΪsp3�����Ȼ��뾧���д��ڵ��������з��»������Ҽ������Լ�����ѡA��B��C����5���ٸ���BeO����Ľṹ���ж�O2-����λ��Ϊ4���ھ�������ԭ�Ӹ�����8��1/8+6��1/2=4��Beԭ�Ӹ�����4����BeO������ܶ�Ϊdg/cm3��������a= 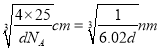 ��
��




