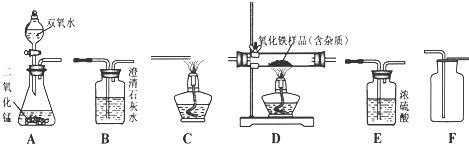
题目内容
13.溶液可能存在电离平衡、水解平衡和溶解平衡等动态平衡.下列说法中正确的是( )| A. | 25℃时,HClO溶液加水稀释,电离程度增大,溶液中H+浓度增大 | |
| B. | 等物质的量浓度的氨水和盐酸等体积混合,存在:2c(NH4+)+c(H+)+c(NH3•H2O)=2c(Cl-)+c(OH-) | |
| C. | MgCl2饱和溶液蒸干可以得到MgCl2•6H2O,继续灼烧得到无水MgCl2 | |
| D. | 已知Ksp(AgCl)=1.8×10-10(mol/L)2,Ksp(Ag2CrO4)=1.8×10-10(mol/L)3,则Ag2CrO4的溶解度小于AgCl |
分析 A、HClO溶液加水稀释,溶液酸性减弱;
B、据电荷守恒和物料守恒分析;
C、氯化镁易水解,MgCl2饱和溶液蒸干,生成氢氧化镁,继续灼烧生成MgO;
D、AgCl与Ag2CrO4的阴阳离子个数比不同,不能根据其Ksp比较溶解度大小.
解答 解:A、HClO溶液加水稀释,电离度增大,溶液酸性减弱,氢离子浓度减小,故A错误;
B、等物质的量浓度的氨水和盐酸等体积混合,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),物料守恒c(NH4+)+c(NH3•H2O)=c(Cl-),两式相加得:2c(NH4+)+c(H+)+c(NH3•H2O)=2c(Cl-)+c(OH-),故B正确;
C、氯化镁易水解,MgCl2饱和溶液蒸干,生成氢氧化镁,继续灼烧生成MgO,故C错误;
D、AgCl与Ag2CrO4的阴阳离子个数比不同,不能根据其Ksp比较溶解度大小,故D错误;
故选B.
点评 本题考查了次氯酸加水稀释时离子浓度变化、溶液中的电荷守恒和物料守恒、盐类水解的应用、Ksp与溶解度的关系,题目难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | C8H16与甲烷互为同系物 | |
| B. | 乙烯只能加成、不能取代,苯只能取代、不能加成 | |
| C. | CH3CH2CH2CH3和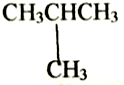 互为同分异构体 互为同分异构体 | |
| D. | 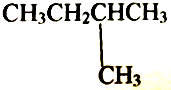 和 和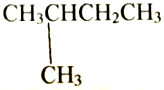 互为同分异构体 互为同分异构体 |
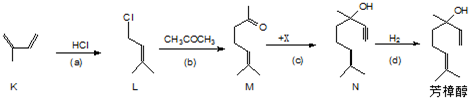
8.某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
 $→_{一定条件}^{Y}$
$→_{一定条件}^{Y}$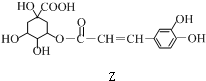
下列有关叙述中不正确的是( )
 $→_{一定条件}^{Y}$
$→_{一定条件}^{Y}$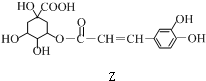
下列有关叙述中不正确的是( )
| A. | X分别与足量的Na、NaOH反应,消耗两者的物质的量之比为5﹕1 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1 mol Z与浓溴水反应最多消耗4molBr2 | |
| D. | 1 mol Z与足量NaOH溶液反应,最多消耗4mol NaOH |
6.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
| A. | 吸氢材料镧镍合金 | B. | 半导体材料砷化镓 | ||
| C. | 高温结构陶瓷材料氮化硅 | D. | 透明陶瓷材料硒化锌 |
3.X、Y、Z为短周期元素,X的单质与水在常温条件下就能剧烈反应生成一种还原性气体,Y的最高价氧化物对应的水化物是一种酸性最强的酸;Z与Y同周期且只能形成ZY3;X、Z的简单离子核外电子排布相同.下列有关叙述正确的是( )
| A. | 离子半径:X>Y>Z | B. | 最外层电子数:Y>Z>X | ||
| C. | 原子序数:Z>Y>X | D. | 单质熔点:X>Z>Y |
4.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | X和Y两元素一定不在同一周期 | |
| C. | 元素Z、W的简单离子的电子层结构相同 | |
| D. | X、W两元素一定能形成两种组成不同的氧化物 |