题目内容
【题目】化学反应有物质的变化过程中还有能量的转化,据此回答下列问题:
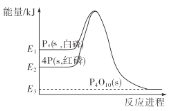
(1)已知甲醇的燃烧热为725.8kJ·mol-1,写出表示其燃烧热的热化学方程式:_______。
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI (g)分子中化学键断裂时需吸收的能量为_____kJ。
(3)己知:CO(g)+2H2(g) →CH3OH(g)△H1=-90.1 kJ·mol-1;3CH3OH(g) ![]() CH3CH=CH2(g)+H2O(g) △H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为________。
CH3CH=CH2(g)+H2O(g) △H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为________。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池。其工作原理示意如图:
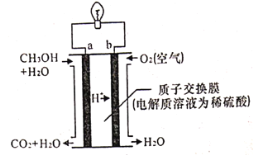
则其负极反应式为____________。
【答案】CH3OH(l)+ ![]() O2(g) = CO2(g) + 2H2O(l) ΔH=-725.8kJ·mol-1 299 3CO(g) + 6H2(g)
O2(g) = CO2(g) + 2H2O(l) ΔH=-725.8kJ·mol-1 299 3CO(g) + 6H2(g) ![]() CH3CH=CH2(g) +3H2O(g) ΔH=-301.3kJ·mol-1 CH3OH-6e-+ H2O = CO2 + 6H+
CH3CH=CH2(g) +3H2O(g) ΔH=-301.3kJ·mol-1 CH3OH-6e-+ H2O = CO2 + 6H+
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量;
(3)依据盖斯定律计算可得;
(4)由氢离子的移动方向可知,通入甲醇和水的一极为负极,通入氧气的一极为正极。
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为22.68kJ×32=725.8KJ,所以甲醇燃烧热的热化学方程式为CH3OH(l)+ ![]() O2(g) = CO2(g) + 2H2O(l) ΔH=-725.8kJ·mol-1,故答案为:CH3OH(l)+
O2(g) = CO2(g) + 2H2O(l) ΔH=-725.8kJ·mol-1,故答案为:CH3OH(l)+ ![]() O2(g) = CO2(g) + 2H2O(l) ΔH=-725.8kJ·mol-1;
O2(g) = CO2(g) + 2H2O(l) ΔH=-725.8kJ·mol-1;
(2)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则依据题意可得如下关系式:2x kJ-436kJ-151kJ=11kJ,解得x=299,故答案为:299;
(3)将已知反应依次编号为①②,由盖斯定律可知,①×3+②得CO与H2合成CH3CH=CH2的热化学方程式3CO(g) + 6H2(g) ![]() CH3CH=CH2(g)+3H2O(g),则ΔH=3ΔH1+ΔH2=3×(-90.1 kJ·mol-1)+(-31.0 kJ·mol-1)=-301.3kJ·mol-1,故答案为:3CO(g) + 6H2(g)
CH3CH=CH2(g)+3H2O(g),则ΔH=3ΔH1+ΔH2=3×(-90.1 kJ·mol-1)+(-31.0 kJ·mol-1)=-301.3kJ·mol-1,故答案为:3CO(g) + 6H2(g) ![]() CH3CH=CH2(g)+3H2O(g) ΔH=-301.3kJ·mol-1;
CH3CH=CH2(g)+3H2O(g) ΔH=-301.3kJ·mol-1;
(4)由氢离子的移动方向可知,通入甲醇和水的一极为负极,通入氧气的一极为正极,酸性条件下,甲醇在负极失电子发生氧化反应二氧化碳,电极反应式为CH3OH-6e-+ H2O = CO2 + 6H+,故答案为:CH3OH-6e-+ H2O = CO2 + 6H+。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案