题目内容
【题目】甲同学利用下图所示装置进行硝酸、氮氧化物的相关实验:
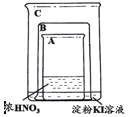
实验1:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为_________________
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为_____________________________________________
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移方向和数目:
________I-+________![]() +________H+=________I2+________NO↑+________H2O
+________H+=________I2+________NO↑+________H2O
(3)打开烧杯B,A液体上方又出现淡棕色,该反应的化学方程式为__________________
实验Ⅱ:因为有其他同学对淀粉KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色,其理由是____________________________________________________________________
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉KI溶液仍然变为蓝色,请你帮忙分析其中的原因_________________________________________________
【答案】 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3NO2+H2O=2HNO3+NO ![]() 2NO+O2=2NO2 常温时铁在浓硝酸中钝化(或生成氧化膜合理即可) 硝酸挥发到淀粉KI溶液中,将KI氧化为I2
2NO+O2=2NO2 常温时铁在浓硝酸中钝化(或生成氧化膜合理即可) 硝酸挥发到淀粉KI溶液中,将KI氧化为I2
【解析】(1)烧杯A液体上方出现大量红棕色气体,这是由于浓硝酸被铜还原生成二氧化氮,该反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。(2)①二氧化氮溶于水生成硝酸和NO,因此红棕色气体消失,该化学方程式为3NO2+H2O=2HNO3+NO。②反应中碘元素化合价从-1价升高到0价,失去1个电子,氮元素化合价从+5价降低到+2价,得到3个电子,根据电子得失守恒、原子守恒以及电荷守恒可知配平后的离子方程式为6I-+2NO3-+8H+=3I2+2NO↑+4H2O,其中用单线桥法标出电子转移方向和数目为 。(3)打开烧杯B,A液体上方又出现淡棕色,这是由于NO与空气中的氧气反应生成二氧化氮,该反应的化学方程式为2NO+O2=2NO2。(4)由于常温时铁在浓硝酸中钝化,不会产生二氧化氮,因此换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色。(5)由于硝酸易挥发,硝酸挥发到淀粉KI溶液中,将KI氧化为I2,因此仍然变为蓝色。
。(3)打开烧杯B,A液体上方又出现淡棕色,这是由于NO与空气中的氧气反应生成二氧化氮,该反应的化学方程式为2NO+O2=2NO2。(4)由于常温时铁在浓硝酸中钝化,不会产生二氧化氮,因此换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色。(5)由于硝酸易挥发,硝酸挥发到淀粉KI溶液中,将KI氧化为I2,因此仍然变为蓝色。

【题目】A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示。

(1)将A、E两种元素的元素符号填入下表中正确的位置上。________
族序数 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ||||||||
三 | ||||||||
(2)A、B、C、D、E、F六种元素中非金属性最强的是____________(填元素符号),B、D两元素可以组成原子个数比为1:1的离子化合物,写出该离子化合物的电子式:______,A、B两元素对应的气态氢化物的稳定性强弱关系是________________(用化学式表示)。
(3)写出D、F两元素的最高价氧化物对应的水化物反应的离子方程式:________________________