题目内容
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
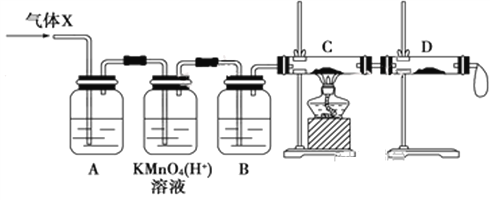
①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
(4)实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是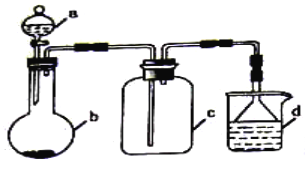 (_____)
(_____)
选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
A | 浓氨水 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
【答案】 H2 Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O Zn+H2SO4=ZnSO4+H2↑ 4.48L 除去SO2 浓硫酸 CuO C中的黑色粉末变为红色,D中的白色固体变为蓝色(合理即可) D
【解析】试题分析:(1)随着硫酸浓度降低,稀硫酸与锌反应生成氢气,所以化学小组所制得的气体中混有的主要杂质气体可能是氢气,反应生成二氧化硫和氢气的方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,故答案为:H2;Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑;
(2)一定质量的Zn与87.5mL 16.0mol/L的H2SO4的浓溶液充分反应,反应后称量剩余锌发现质量减少了78g,则参加反应Zn的物质的量为![]() =1.2mol,H2SO4的物质的量为0.0875L×16mol/L=1.4mol,由于锌过量,硫酸完全反应,设与浓硫酸反应的Zn为xmol,与稀硫酸反应的Zn为ymol,则:
=1.2mol,H2SO4的物质的量为0.0875L×16mol/L=1.4mol,由于锌过量,硫酸完全反应,设与浓硫酸反应的Zn为xmol,与稀硫酸反应的Zn为ymol,则:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4=ZnSO4+H2↑
y y y
由题意可知:x+y=1.2,2x+y=1.4,解得x="0.2" y=1.0,
产生SO2体积(标准状况下)=0.2mol×22.4L/mol=4.48L,故答案为:4.48;
(3)①气体(X)中可能含有二氧化硫和氢气,酸性KMnO4溶液可以吸收二氧化硫气体,将氢气通入加热的硬质玻璃管前需要干燥,因此B中添加的试剂是浓硫酸,故答案为:除去SO2;浓硫酸;
②氢气含有氧化铜或氧化铁能够说出水,在用无水硫酸铜可以检验说出的水,如果气体X中混有较多量某杂质气体(氢气),则无水硫酸铜变蓝色,故答案为:CuO;C中的黑色粉末变为红色,D中的白色固体变为蓝色;
(4)A、氨气的密度比空气密度小,应该采用向下排空气法收集,装置c中的导管应该改为短进长出,故A错误;B、浓硫酸可以与亚硫酸反应,生成二氧化硫,SO2气体的密度比空气大,能使用向上排空气法,SO2气体有毒,应用氢氧化钠吸收,防止污染,故B错误;C、铜与稀硝酸反应生成产物为一氧化氮,无法达到二氧化氮,一氧化氮、二氧化氮的尾气吸收不能使用水,故C错误;D、用KMnO4和浓盐酸可在常温下制取氯气,氯气的密度比空气大,能使用向上排空气法,氯气用氢氧化钠溶液吸收,故D正确;故选D;