题目内容
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:

①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1="-57.3" kJ/mol
CH3COOH(aq) H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:

①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1="-57.3" kJ/mol
CH3COOH(aq)
 H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
(1)①醋酸为共价化合物,只在水溶液中才能电离(2分);
②<;>;=(3分,各1分);
③1.3×10-3 (1分);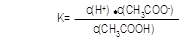 ="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
(2)CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol (3分)
(3)c(CH3COOH)+c(CH3COO-)=2c(Na+)或c(CH3COOH)+c(CH3COO-)=0.1mol/L;
c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (4分;各2分)
②<;>;=(3分,各1分);
③1.3×10-3 (1分);
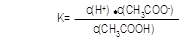 ="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L(2)CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol (3分)
(3)c(CH3COOH)+c(CH3COO-)=2c(Na+)或c(CH3COOH)+c(CH3COO-)=0.1mol/L;
c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (4分;各2分)
试题分析:(1)①醋酸是共价化合物,液态醋酸中不存在自由移动的离子;
②对于弱电解质溶液而言,溶液越稀越易电离,所以b点醋酸的电离程度大于a点,H+的物质的量b点大于a点;尽管氢离子物质的量在增大,但增大的幅度不如溶液体积增大的多,所以离子浓度减小,因此b点醋酸根离子浓度小于a点;无论a还是b点,醋酸的物质的量不变,所以需要氢氧化钠的物质的量相等;
③醋酸电离产生等浓度的CH3COO-和H+,所以此时c(CH3COO-)约为1.3×10-3 mol/L;b点的平衡常数K= c(CH3COO-)·c(H+)/ c(CH3COOH)=( 1.3×10-3 mol/L)2/0.10mol/L=1.7×10-5 mol/L;
(2)将已知2个热化学方程式相加得:CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol 即为稀醋酸与稀烧碱溶液反应的热化学方程式;
(3)醋酸电离使溶液呈酸性,醋酸钠水解使溶液呈碱性,浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,说明醋酸的电离程度大于醋酸钠的水解程度。则混合液中的物料守恒有:醋酸和醋酸根离子的浓度和是钠离子浓度的2倍,c(CH3COOH)+c(CH3COO-)=2c(Na+);或者混合液中醋酸和醋酸根离子的浓度和是0.10mol/L,c(CH3COOH)+c(CH3COO-)=0.1mol/L;根据以上分析,醋酸的电离程度大于醋酸钠的水解程度,所以混合液中离子浓度最大的是醋酸根离子,其次是钠离子,再次是氢离子,最小是氢氧根离子,c(CH3COO-)>c(Na+)c(H+)>c(OH-)。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
 O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。  2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
 FeO(s)+CO(g)
FeO(s)+CO(g)


 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
 H2(g)+
H2(g)+