题目内容
I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示:
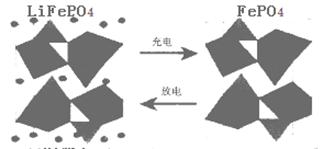
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
Ⅰ.(1)①0.13mol/(L·min)(2分) ②放(1分) 0.17(2分)
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH =-442.8 kJ/mol (2分)
Ⅱ.(1)正(1分) FePO4+e-+Li+=LiFePO4 (2分) (2)0.168(2分) 2(2分)
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH =-442.8 kJ/mol (2分)
Ⅱ.(1)正(1分) FePO4+e-+Li+=LiFePO4 (2分) (2)0.168(2分) 2(2分)
试题分析:Ⅰ.(1)①由表格数据和反应的化学方程式可知可知,氢气的物质的量与CO2的物质的量是相等的,则二氧化碳的浓度变化为1.6mol÷2L=0.8mol/L,则v=0.8mol/L÷6min=0.13mol/(L·min);
②温度升高,氢气的含量减少,则升高温度平衡逆向移动,正反应为放热反应;
H2O(g)+CO(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
则K=
 =0.17
=0.17(2)已知在常温常压下:① 2CH3OH(l)+3O2(g)=2CO2(g)+ 4H2O(g) ΔH =-1275.6 kJ/mol、
② 2CO (g)+ O2(g)=2CO2(g) ΔH =-566.0 kJ/mol、③ H2O(g)=H2O(l) ΔH=-44.0 kJ/mol,则根据盖斯定律可知(①-②+③×4)÷2即得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH =-442.8 kJ/mol。
Ⅱ.(1)放电时铁元素的化合价由+3价降低到+2价,得到电子,因此是正极,电极反应式为FePO4+e-+Li+=LiFePO4;
(2)硫酸铜和氯化钠的物质的量均是0.01mol,由于通过0.02mol电子,因此铜离子青海方,氯离子不足,即氯离子完全放电后溶液中的氢氧根离子又放电。所以电解过程可以看做是3个阶段,度÷第一阶段相当于是电解氯化铜,第二阶段是电解硫酸铜,所以阳极产生氯气是0.01mol÷2=0.005mol,氧气是(0.02mol-0.01mol)÷4=0.0025mol,则体积共计是(0.005mol+0.0025mol)×22.4L/mol=0.168L。氧气是0.0025mol,则根据反应式2CuSO4+2H2O
 2Cu+2H2SO4+O2↑可知产生氢离子的物质的量是0.0025mol×4=0.01mol,氢离子浓度是0.01mol÷1L=0.01mol/L,则pH=2。
2Cu+2H2SO4+O2↑可知产生氢离子的物质的量是0.0025mol×4=0.01mol,氢离子浓度是0.01mol÷1L=0.01mol/L,则pH=2。
练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目

 CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
 H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol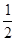 O2(g)=H2O(g)
O2(g)=H2O(g) 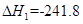 kJ·mol-1,② C(s)+
kJ·mol-1,② C(s)+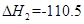 kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)
kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) 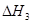 ,则
,则 (NH4)2CO3 (aq) △H1
(NH4)2CO3 (aq) △H1
 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1