题目内容
8. 醋酸是中学常用的一种弱酸.
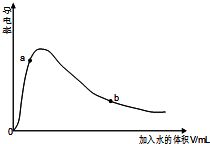
醋酸是中学常用的一种弱酸.(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:
①开始时导电率为0说明:醋酸为共价化合物,只在水溶液中才能电离.
②比较a、b点的相关性质(填“>”、“<”、“=”):
n(H+):a<b;c(CH3COO-):a>b;
完全中和时消耗NaOH的物质的量:a=b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为1.3×10-3mol/L;b点时醋酸的电离平衡常数值约为1.69×10-5.
(2)已知:H+(aq)+OH-(aq)=H2O(l)△H1=-57.3kJ/mol
CH3COOH(aq)?H+(aq)+CH3COO-(aq)△H2=+1.3kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式:CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)△H=-56.0kJ/mol.
分析 (1)冰醋酸中醋酸以分子存在,溶液中不含自由移动离子,所以冰醋酸不导电;加水稀释促进醋酸电离,
离子浓度增大,溶液导电能力增强;当离子浓度达到一定程度后继续加水,促进醋酸电离但溶液中离子浓度减小,溶液导电能力降低;
①溶液导电能力与离子浓度成正比;
②醋酸溶液浓度越小,其电离程度越大;溶液导电能力与离子浓度成正比;
完全中和时消耗NaOH的物质的量与醋酸的物质的量成正比,与醋酸电离程度无关;
③醋酸溶液中氢离子浓度大多数来自于醋酸电离,水的电离程度很小,所以醋酸溶液中c(CH3COO-)≈c(H+);
醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$;
(2)根据盖斯定律进行计算.
解答 解:(1)冰醋酸中醋酸以分子存在,溶液中不含自由移动离子,所以冰醋酸不导电;加水稀释促进醋酸电离,离子浓度增大,溶液导电能力增强;当离子浓度达到一定程度后继续加水,促进醋酸电离但溶液中离子浓度减小,溶液导电能力降低;
①溶液导电能力与离子浓度成正比,醋酸为共价化合物,只在水溶液中才能电离,冰醋酸没有自由移动离子,所以开始时导电率为0,故答案为:醋酸为共价化合物,只在水溶液中才能电离;
②醋酸溶液浓度越小,其电离程度越大,所以n(H+):a<b;溶液导电能力与离子浓度成正比,根据图知,c(CH3COO-):a>b;
完全中和时消耗NaOH的物质的量与醋酸的物质的量成正比,与醋酸电离程度无关,a、b两处醋酸最终电离出氢离子物质的量相等,所以完全中和时消耗NaOH的物质的量:a=b,
故答案为:<;>;=;
③醋酸溶液中氢离子浓度大多数来自于醋酸电离,水的电离程度很小,所以醋酸溶液中c(CH3COO-)≈c(H+)=1.3×10-3 mol/L;
醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1.3×1{0}^{-3}×1.3×1{0}^{-3}}{0.10}$=1.69×10-5,
故答案为:1.3×10-3; 1.69×10-5;
(2)H+(aq)+OH-(aq)=H2O(l)△H1=-57.3kJ/mol ①
CH3COOH(aq)?H+(aq)+CH3COO-(aq)△H2=+1.3kJ/mol ②
根据盖斯定律将方程式①+②得CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)
△H=△H1+△H2=(-57.3kJ/mol)+(+1.3kJ/mol)=-56.0kJ/mol,
故答案为:CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)△H=-56.0kJ/mol.
点评 本题考查弱电解质的电离、中和热的计算等知识点,明确弱电解质电离特点、盖斯定律是解本题关键,注意:电解质溶液导电性强弱与离子浓度成正比,与电解质强弱无关,为易错点.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | Al3++3HCO${\;}_{3}^{-}$=Al(OH)3↓+3CO2↑ | B. | Al3++3H2O?Al(OH)3+3H+ | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | HCO${\;}_{3}^{-}$+H2O?H3O++CO${\;}_{3}^{2-}$ |
| A. | 麦芽糖和稀硫酸共热 | |
| B. | 蛋白质溶液中加入饱和NaCl溶液,有沉淀析出 | |
| C. | 蛋白质溶液中加入浓NaOH溶液 | |
| D. | 氨基酸中加入盐酸 |
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 达到平衡时,O2的转化率是31.5% | |
| C. | 达到平衡时,SO2的转化率是31.5% | |
| D. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 |

| A. | 乙醇 | B. | 盐酸 | C. | NaOH | D. | HNO3 |
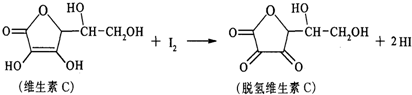
| A. | 上述反应为取代反应 | |
| B. | 维生素C能使高锰酸钾酸性溶液褪色 | |
| C. | 维生素C不溶于水,可溶于有机溶剂 | |
| D. | 维生素C的分子式为C6H10O6 |