题目内容
16.在体积恒定的密闭容器中,一定量的SO2与1.00mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2?2SO3△H<0.当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的92.125%.下列有关叙述正确的是( )| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 达到平衡时,O2的转化率是31.5% | |
| C. | 达到平衡时,SO2的转化率是31.5% | |
| D. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 |
分析 A.无论凡是否达到平衡状态,都存在SO3的生成速率与SO2的消耗速率相等的关系;
B.利用压强之比等于物质的量之比计算平衡时混合气体总物质的量,结合气体的物质的量减少计算SO2的起始物质的量,再利用差量法计算参加反应SO2、O2的物质的量,进而计算O2的转化率;
C.根据B中计算数据,可以计算SO2的转化率;
D.降低温度,平衡向正反应方向移动,正反应速率大于逆反应速率.
解答 解:A.化学反应中,反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在SO3的生成速率与SO2的消耗速率相等的关系,不能作为判断是否达到平衡的依据,故A错误;
B.气体的物质的量减少0.315mol时反应达到平衡,则:
2SO2+O2?2SO3 物质的量减小△n
1mol 1mol
0.315mol 0.315mol
故氧气的转化率为$\frac{0.315mol}{1mol}$×1005=31.5%,故B正确;
C.压强之比等于物质的量之比,故平衡时混合气体总物质的量为0.315mol÷(1-92.125%)=4mol,故SO2的起始物质的量为4mol-1mol=3mol,气体的物质的量减少0.315mol时反应达到平衡,则:
2SO2+O2?2SO3 物质的量减小△n
2mol 1mol
0.63mol 0.315mol
故SO2的转化率为$\frac{0.63mol}{3mol}$×1005=21%,故C错误;
D.降低温度,平衡向正反应方向移动,则正反应速率减小程度比逆反应速率减小程度小,导致正反应速率大于逆反应速率,故D错误,
故选:B.
点评 本题考查化学平衡的计算、平衡状态判断、化学平衡移动等,题目难度中等,C中注意在恒温恒容下气体的压强之比等于物质的量之比,再利用差量法进行计算.

| A. | S-诱抗素的分子结构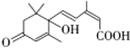 中含有苯环、羟基、羰基、羧基(提示: 中含有苯环、羟基、羰基、羧基(提示: 是羰基) 是羰基) | |
| B. | 1mol阿司匹林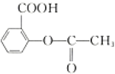 可与2molNaOH发生反应 可与2molNaOH发生反应 | |
| C. | 食品香精菠萝酯的生产路线(反应条件略去)如下图,步骤(2)产物中残留的烯丙醇可用溴水检验: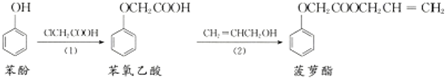 | |
| D. | 有机物A为茉莉香型香料.已知 ,则A的分子式为C14H18O ,则A的分子式为C14H18O |
| A. | 纯净物 | B. | 化合物 | C. | 电解质 | D. | 强电解质 |
| A. | 摩尔质量:g | B. | 物质的量浓度:L/mol | ||
| C. | 物质的量:mol | D. | 气体摩尔体积:L |
| A. | c(CN-)<c(HCN) | B. | c(HCN)+c(CN-)═0.04 mol/L | ||
| C. | c(OH-)═c(H+)+c(HCN) | D. | c(Na+)>c(CN-)>c(H+)>c(OH-) |
 如图所示装置有多种用途,请回答下列问题:
如图所示装置有多种用途,请回答下列问题: .
. 醋酸是中学常用的一种弱酸.
醋酸是中学常用的一种弱酸.