题目内容
16. 用如图实数装置进行中加热测定实验,请回答下列问题:
用如图实数装置进行中加热测定实验,请回答下列问题:(1)大小烧杯之间天满碎泡沫塑料除了其支撑作用外,还有的作用是减少实验过程中的热量损失,从装置上看,图中缺少的一中玻璃仪器是环形玻璃搅拌棒
(2)使用补全仪器后的装置进行实验,取50ml 0.25mol•L-1H2SO4溶液与50mL 0.55mol•L-1NaOH溶液在烧杯中进行中和反应,三次实验温度平均升高3.4℃,已知中和后生产的任意的比热容c为4.2J.g-1℃,任意的密度均为1g.cm-3,忽略任意混合后的体积变化.通过计算可得中和的热△H=-57.12KJ.mol-1(保留2位小数),H2SO4和NaOH反应的化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.12KJ•mol-1
(3)若将NaOH溶液变为相同体积,相同浓度的氨水,测得中和热为△H2,则△H的关系为△H2>△H(填“<”“>”“=”,理由是中和过程中NH3•H2O电离吸热.
分析 (1)中和热测定实验成败的关键是保温工作;根据量热计的构造来判断该装置的缺少仪器;
(2)先根据反应方程式计算生成水的物质的量,再根据比热容计算放出的热量,放出的热量除以水的物质的量就是中和热,并根据热化学方程式的书写方法来写热化学方程式;
(3)根据弱电解质电离吸热分析.
解答 解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失;由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:减少实验过程中的热量损失;环形玻璃搅拌棒;
(2)取50mL0.25mol•L-1的H2SO4溶液与50mL0.55mol•L-1 NaOH溶液在小烧杯中进行中和反应,生成水的物质的量为0.025mol,溶液的质量为100g,三次实验温度平均升高3.4℃,放出的热量Q=4.2J/(g•℃)×100g×3.4℃=1428J=1.428KJ,所以生成1mol水放出的热量为$\frac{1.428KJ}{0.025}$=57.12KJ,即中和热△H=-57.12KJ•mol-1,热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.12KJ•mol-1,
故答案为:-57.12;$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.12KJ•mol-1;
(3)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.12kJ,由于△H均为负值,所以△H2>△H,
故答案为:>;中和过程中NH3•H2O电离吸热.
点评 本题主要考查中和热的测定,题目难度中等,注意热量计算公式的应用中c=4.2J/(g•℃),要注意热量单位的换算.

| A. | 钠和铁一样,都能在氯气中燃烧生成金属氯化物 | |
| B. | 氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸 | |
| C. | 氯气跟变价金属反应生成高价金属氯化物 | |
| D. | 液氯是氯气的水溶液,它能使干燥的有色布条褪色 |
| A. | 2mol/L | B. | 1.2mol/L | C. | 0.8mol/L | D. | 无法确定 |
| A. | Fe2+.K+.SO42-.NO3- | B. | Mg2+.NH4+.SO42-.C1- | ||
| C. | Na+.K+.SO42-.NO3- | D. | Ba2+.Na+.SO42-.MnO4- |
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | B. | 二溴乙烷和水,溴苯和水,酒精和水 | ||
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | D. | 苯和水,甲苯和水,己烷和水 |
| A. | 所含质子数和电子数相等的微粒一定是原子 | |
| B. | 两种微粒如果核外电子排布相同,化学性质就一定相同 | |
| C. | 质量数相同的原子其化学性质一定相同 | |
| D. | 具有相同核电荷数的原子或单核离子一定是同种元素 |



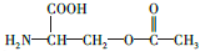 .
.
 +CO$→_{△}^{HCl}$
+CO$→_{△}^{HCl}$ .
.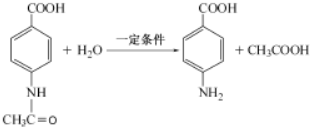 .
.