题目内容
【题目】一定量的锌与100mL18.5molL﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1molL﹣1.则生成的气体中SO2和H2的体积比为( )
A.1:2B.2:1C.1:4D.4:1
【答案】C
【解析】
锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,生成气体为SO2和H2的混合物,物质的量为![]() =1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩=
=1.5mol,剩余硫酸的物质的量为:n(H2SO4)剩=![]() ×1L×0.1mol/L=0.05mol,
×1L×0.1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=0.1L×18.5mol/L﹣0.05mol=1.8mol,根据反应的化学方程式计算。
n(H2SO4)浓=0.1L×18.5mol/L=1.85mol,
剩余硫酸的物质的量为:n(H2SO4)剩=![]() ×1L×0.1mol/L=0.05mol,
×1L×0.1mol/L=0.05mol,
消耗硫酸的物质的量为:n(H2SO4)消耗=1.85mol﹣0.05mol=1.8mol,
锌与浓硫酸发生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,随着反应的进行,硫酸浓度降低,发生:Zn+H2SO4=ZnSO4+H2↑,
生成气体为SO2和H2的混合物,物质的量为![]() =1.5mol,
=1.5mol,
设混合物气体中含有xmolSO2,ymolH2,
Zn+2H2SO4=ZnSO4+SO2↑+H2O
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑
ymol ymol
则有:![]()
解之得:![]()
所以n(SO2):n(H2)=x:y=0.3:1.2=1:4。

【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
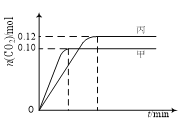
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%