题目内容
(15分)
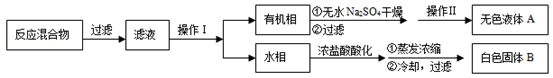
某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.
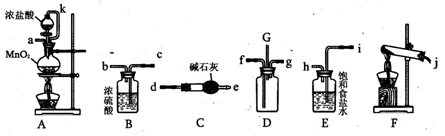
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是 。
(2)装置E的作用是 ,橡胶管k的作用是 。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是 。
(4)装置F中试管内发生反应的化学方程式____ 。
(5)接入D装置的两根导管左边较长、右边较短,目的是______ .
(6)整套装置从左向右的连接顺序是(j)接( )( )接(f)(g)接( )( )接( )( )接(a).
某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.

请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是 。
(2)装置E的作用是 ,橡胶管k的作用是 。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是 。
(4)装置F中试管内发生反应的化学方程式____ 。
(5)接入D装置的两根导管左边较长、右边较短,目的是______ .
(6)整套装置从左向右的连接顺序是(j)接( )( )接(f)(g)接( )( )接( )( )接(a).
(15分)
(1)检查装置的气密性(1分)
(2)除去氯气中的氯化氢(2分)使分液漏斗中的盐酸顺利流下(2分)
(3)在G连接导管直接通入盛有烧碱的烧杯中(2分)
(4)2NH4Cl+Ca(OH)2 △ CaCl2+2H2O+2NH3↑(3分)
(5)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(6)(j)接(d)(e)接(f)(g)接(b)(c)接(h)(i)接(a)(3分,全对才得分)
(1)检查装置的气密性(1分)
(2)除去氯气中的氯化氢(2分)使分液漏斗中的盐酸顺利流下(2分)
(3)在G连接导管直接通入盛有烧碱的烧杯中(2分)
(4)2NH4Cl+Ca(OH)2 △ CaCl2+2H2O+2NH3↑(3分)
(5)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(6)(j)接(d)(e)接(f)(g)接(b)(c)接(h)(i)接(a)(3分,全对才得分)
试题分析:(1)连接好装置后,需进行装置气密性的检查;
(2)D为纯净干燥的氯气与纯净干燥氨气反应的装置,所以反应前应先除杂、干燥,因此装置E的作用是除去氯气中的氯化氢气体,橡胶管k与分液漏斗的上口相连,达到连通器的效果,方便浓盐酸顺利滴下;
(3)从G处逸出黄绿色气体氯气,氯气有毒,直接排放会污染空气,所以应在G处接一导气管通入氢氧化钠溶液中;
(4)F为实验室制取氨气的装置,所以F中发生的化学方程式为
2NH4Cl+Ca(OH)2△ CaCl2+2H2O+2NH3↑
(5)因为氯气浓度较大,氨气密度较小,所以左边应通入氨气,右边通入氯气使二者混合均匀;
(6)整套装置从左向右的连接顺序是(j)….,说明装置左边是生成氨气的装置,经过碱石灰干燥通入D的f口中,产生的氯气经过饱和食盐水除杂、浓硫酸干燥,通入D的g口中,所以装置的连接顺序是(j)接(d)(e)接(f)(g)接(b)(c)接(h)(i)接(a)。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目