题目内容
19.下列各组混合物不能用分液漏斗分离的是( )| A. | 硝基苯和水 | B. | 乙酸乙酯和水 | C. | 乙醇和水 | D. | 溴苯和NaOH溶液 |
分析 根据分液漏斗可以将互不相溶的两层液体分开,则分析选项中物质的溶解性即可.
解答 解:A.硝基苯和水不溶,能用分液漏斗进行分离,故A错误;
B.乙酸乙酯和水不溶,能用分液漏斗进行分离,故B错误;
C.乙醇和水互溶,不能用分液漏斗进行分离,故C正确;
D.溴苯和NaOH溶液不溶,能用分液漏斗进行分离,故D错误.
故选C.
点评 本题考查了物质的分离和提纯,难度不大,注意分液漏斗能分离的物质必须是互不相溶的液体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列变化可通过一步实验直接完成的是( )
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Al→Al(OH)3 | D. | SiO2→H2SiO3 |
9.已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种
则第6项烷烃分子的化学式( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | C17H36 | … | … |
| A. | C16H34 | B. | C22H46 | C. | C26H54 | D. | C27H56 |
14.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | 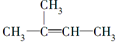 +Br2(CCl4)→ +Br2(CCl4)→ | |
| B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | CH4+Cl2$\stackrel{光照}{→}$ |
4.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 蛋白质、糖类、油脂均能发生水解反应 |
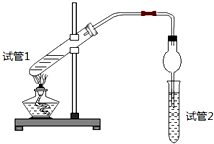
8.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用日图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测试管2中有机层的厚度,实验记录如下:
 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH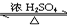 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH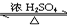 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
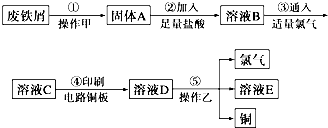
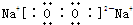 ;
; 双鸭山市第一中学高二化学兴趣小组设计的苯和液溴反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
双鸭山市第一中学高二化学兴趣小组设计的苯和液溴反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑. .
.