题目内容
16.下列各组性质的比较中正确的是( )| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 还原性:Cl->Br->I- |
分析 A、同主族自上而下,非金属性减弱,非金属性越强,最高价氧化物对应水化物的酸性越强;
B、同周期从左到右,金属性减弱,金属性越弱,最高价氧化物对应水化物的碱性越弱;
C、金属性越强,氢化物越稳定,同周期随原子序数增大,非金属性增强;
D、非金属性越强,阴离子的还原性越弱,同主族自上而下,非金属性减弱.
解答 解:A、同主族自上而下,非金属性减弱,所以非金属性Cl>Br>I,非金属性越强,最高价氧化物对应水化物的酸性越强;所以酸性:HClO4>HBrO4>HIO4,故A错误;
B、同周期从左到右,金属性减弱,金属性越弱,最高价氧化物对应水化物的碱性越弱,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故B正确;
C、同周期随原子序数增大,非金属性增强,所以非金属性Cl>S>P,非金属性越强,氢化物越稳定,所以氢化物稳定性:HCl>H2S>PH3,故C错误;
D、同主族自上而下,非金属性减弱,所以非金属性Cl>Br>I,非金属性越强,阴离子的还原性越弱,所以离子还原性:Cl-<Br-<I-,故D错误;
故选B.
点评 本题考查元素周期律知识,为高考常见题型,侧重于基础知识的考查,注意把握元素周期律的递变规律以及金属性、非金属性与对应单质、化合物的关系,把握比较角度,难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
5.很多地区连日雾霾天气的罪魁祸首之一是PM2.5,2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标.下面关于PM2.5的说法中不正确的是( )
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物 | |
| B. | PM2.5只是地球大气成分中含量很少的组分,对空气质量和能见度等没什么影响 | |
| C. | PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远 | |
| D. | PM2.5主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物等 |
4.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 蛋白质、糖类、油脂均能发生水解反应 |
1.为探究同周期元素性质的递变规律,某课外小组同学进行了如下实验:
请在下表中填写与实验步骤对应的实验现象序号:
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中; 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3.将一小段镁带投入稀盐酸中; 4.将一小片铝投入稀盐酸中. |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不剧烈,产生无色气体 D.有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
8.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用日图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测试管2中有机层的厚度,实验记录如下:
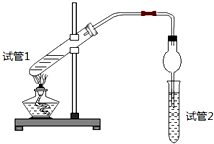 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH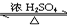 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
 (1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH
(1)写出实验A中试管1反应的化学方程式CH3COOH+C2H5OH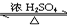 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(2)实验D的目的是与实验C相比照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(3)分析实验A(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
(4)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
5.已知1~18号元素的离子cY2-、bX+、aW2+、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>d | B. | 原子半径:X<W | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子的还原性:Y2->Z- |
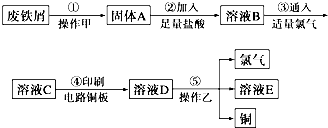
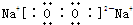 ;
;