题目内容
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
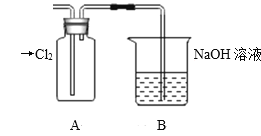
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
【答案】X>Z>Y A B Cl2+Na2S=2NaCl+S↓ B 变蓝 原子半径递增,得电子能力递减
【解析】
I.金属越活泼,与水或酸反应置换出氢气越容易;
根据同一周期的元素,原子序数越大,原子的最外层电子数越多,原子半径越小,元素的最高价氧化物对应的水化物的碱性越弱分析判断;
II. (1)要验证Cl的非金属性比S强,可通过单质之间的置换反应判断;
(2)根据判断元素非金属性强弱的方法进行判断;
(3)活动性强的可以将活动性弱的置换出来,结合碘单质遇淀粉溶液变为蓝色判断;同一主族元素从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱。
I.根据实验1可知X、Z与水混合,金属X与水反应比金属Z剧烈,说明金属活动性X>Z;根据实验2:等质量的金属Z和金属Y分别加入到5mL1.0mol/L盐酸中,金属Z与盐酸反应比金属Y剧烈,说明金属活动性Z>Y,故三种金属活动性X>Z>Y;
A.同一周期的元素,原子序数越大,原子半径越小,金属活动性越弱,所以原子序数:X<Z<Y;A正确;
B.同一周期的元素,原子最外层电子数越多,原子半径越小,元素的金属性越弱,所以三种元素的原子的最外层电子数X<Z<Y,B错误;
C.同一周期的元素,原子最外层电子数越多,原子半径越小,元素的金属性越弱,由元素的金属性X>Z>Y,可知原子半径:Y<Z<X,C错误;
D.Y的金属性最弱,所以Y的最高价氧化物对应水化物的碱性最弱,D错误;
故合理选项是A;
II. (1) A.Cl2可以与Na2SO3溶液反应产生HCl、Na2SO4,但不能判断Cl与S非金属性强弱,A错误;
B.Na2S溶液与Cl2发生反应:Cl2+Na2S=2NaCl+S↓,会看到溶液中产生淡黄色浑浊,因此可以证明元素的非金属性Cl>S,B正确;
C.Cl2与Na2SO4溶液不能反应,无明显现象,不能判断Cl与S非金属性强弱,C错误;
故合理选项是B;
(2)A.元素的非金属性越强,其相应的氢化物稳定性越强,根据HCl比H2S稳定可知元素的非金属性Cl>S,A不符合题意;
B.HClO氧化性比H2SO4强,与元素的非金属性强弱无关,B符合题意;
C.元素的非金属性越强,其最高价含氧酸的酸性越强,由于HClO4酸性比H2SO4强,可知元素的非金属性Cl>S,C不符合题意;
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS,说明Cl2的氧化性比S强,从而可证明元素的非金属性Cl>S,D不符合题意;
故合理选项是B;
(3)活动性强的可以将活动性弱的置换出来,将Cl2通入KI淀粉溶液中,发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色;Cl元素的非金属性比I强是由于同主族元素从上到下,原子半径递增,得电子能力递减,故单质的氧化性逐渐减弱,元素的非金属性逐渐减弱。

 阅读快车系列答案
阅读快车系列答案