题目内容
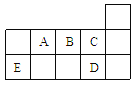
【题目】A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置_____________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是_______(用离子符号表示)。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_____。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:_____;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_____。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式___。
【答案】第三周期ⅠA族 S2-->O2--->Na+ 离子键和共价键 Fe2O3+2Al![]() 2Fe+Al2O3 SiO2+2OH--===SiO32-+H2O 2SO2+O2+2H2O===2H2SO4
2Fe+Al2O3 SiO2+2OH--===SiO32-+H2O 2SO2+O2+2H2O===2H2SO4
【解析】
C元素的原子最外层电子数是次外层电子数的三倍,根据核外电子排布规律,推出C为O,C与F同主族,即F为S,都是短周期元素,D是所在周期原子半径最大的主族元素,四种元素原子序数依次增大,即D为Na,A与D同主族,即A为H,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,Na和S之间的单质没有气体,即B为N,据此分析;
C元素的原子最外层电子数是次外层电子数的三倍,根据核外电子排布规律,推出C为O,C与F同主族,即F为S,都是短周期元素,D是所在周期原子半径最大的主族元素,四种元素原子序数依次增大,即D为Na,A与D同主族,即A为H,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,Na和S之间的单质没有气体,即B为N,
(1)D元素为Na,位于周期表中第三周期IA族;
答案为第三周期IA族;
(2)三种元素形成简单离子是O2-、Na+、S2-,离子半径大小顺序是S2->O2->Na+;
答案为S2->O2->Na+;
(3)按照原子个数比,化学式为H4N2O3,即NH4NO3,硝酸铵属于离子化合物,是由NH4+和NO3-组成,即含有化学键为离子键和极性共价键;
答案为离子键和极性共价键;
(4)E为金属元素,按照元素周期表,推出E为Al,利用Al的还原性强,与氧化铁发生:2Al+Fe2O3 ![]() 2Fe+Al2O3,E是非金属元素,其单质在电子工业中有重要的应用,即E元素为Si,SiO2属于酸性氧化物,与强碱反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
2Fe+Al2O3,E是非金属元素,其单质在电子工业中有重要的应用,即E元素为Si,SiO2属于酸性氧化物,与强碱反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
答案为2Al+Fe2O3 ![]() 2Fe+Al2O3;SiO2+2OH-=SiO32-+H2O;
2Fe+Al2O3;SiO2+2OH-=SiO32-+H2O;
(5)FC2为SO2,SO2以还原性为主,与氧气、水蒸气反应的化学方程式为2SO2+O2+2H2O=2H2SO4;
答案为2SO2+O2+2H2O=2H2SO4。

【题目】化学反应的ΔH等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH为( )
Si(s)+4HCl(g),该反应的反应热ΔH为( )
A. +412 kJ·mol-1B. -412 kJ·mol-1C. +236 kJ·mol-1D. -236 kJ·mol-1