题目内容
【题目】已知化合物X由3种元素组成,某学习小组进行了如下实验:
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是____________(用元素符号表示);
(2)X与水反应的化学方程式是______________;
(3)X中一种元素对应的单质,可与石灰乳反应得到漂白粉,写出该反应的化学方程式:_______。
【答案】K、Cl、O K3ClO+H2O=KCl+2KOH 2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
【解析】
取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,说明X中含有K元素;X中一种元素对应的单质,可与石灰乳反应得到漂白粉,说明X中含有Cl元素,X加水完全溶解,无气体产生,溶液呈碱性,说明含有O。
取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和,说明生成的碱为0.02 mol,中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀AgCl,n(AgCl)=4.305g÷143.5g/mol=0.03 mol,根据Cl守恒,说明1.685gX中含有0.01 mol氯,因此得出X与水反应生成KOH和KCl,再根据质量得出氧的质量为1.685g -0.01mol×35.5gmol-1 -(0.01mol + 0.02mol) ×39gmol-1 =0.16g,故氧的物质的量n(O)=![]() =0.01mol,n(K):n(Cl):n(O)=0.03mol:0.01mol:0.01mol=3:1:1,因此X的化学式为K3ClO。
=0.01mol,n(K):n(Cl):n(O)=0.03mol:0.01mol:0.01mol=3:1:1,因此X的化学式为K3ClO。
取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,说明X中含有K元素;X中一种元素对应的单质,可与石灰乳反应得到漂白粉,说明X中含有Cl元素,X加水完全溶解,无气体产生,溶液呈碱性,说明含有O。
取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和,说明生成的碱为0.02 mol,中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀AgCl,n(AgCl)=4.305g÷143.5g/mol=0.03 mol,根据Cl守恒,说明1.685gX中含有0.01 mol氯,因此得出X与水反应生成KOH和KCl,再根据质量得出氧的质量为1.685g -0.01mol×35.5gmol-1 -(0.01mol + 0.02mol) ×39gmol-1 =0.16g,故氧的物质的量n(O)=![]() =0.01mol,n(K):n(Cl):n(O)=0.03mol:0.01mol:0.01mol=3:1:1,因此X的化学式为K3ClO。
=0.01mol,n(K):n(Cl):n(O)=0.03mol:0.01mol:0.01mol=3:1:1,因此X的化学式为K3ClO。
⑴根据上面分析得出X中3种元素是K、Cl、O,故答案为K、Cl、O;
⑵X与水反应的化学方程式是K3ClO+H2O=KCl+2KOH,故答案为:K3ClO+H2O=KCl + 2KOH;
⑶氯气与石灰乳反应的化学方程式2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O。

【题目】一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成HClO,遇有机物易燃烧或爆炸,42℃以上易分解。某化学兴趣小组设计如图装置以制备Cl2O(支撑及夹持装置已省略)。
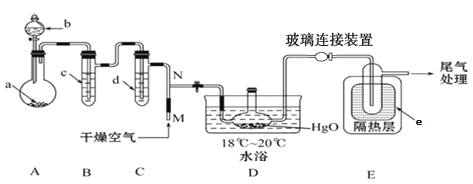
已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。 ②Cl2O的部分性质如下表。
熔点 | 沸点 | 制备方法 |
-120.6 ℃ | 3.8℃ | 2HgO+2Cl2 = Cl2O+HgCl2·HgO |
请回答:
(1)指出该制备装置中存在的一个明显错误______________(经改进后进行有关实验)。
(2)装置C中盛有的试剂是______________。
(3)写出装置A中制备Cl2的化学方程式__________。
(4)装置D中采用18℃~20℃水浴的原因之一是如温度过低,反应速率慢,另一个可能的原因是 ___________。
(5)装置D、E间的连接方式与A、B、C间的连接方式有明显的差别,装置D、E间采用这种连接方式的理由是____________。
(6)Cl2O是市场上一种比较理想的饮水消毒剂,ClO2和Cl2O在消毒时自身均被还原为Cl-,则ClO2消毒能力是等质量Cl2O的_________倍(结果保留两位小数)
(7)文献报道说,Cl2O的另一种制备方法是利用Cl2与足量的Na2CO3溶液反应来制得,写出该反应的化学方程式:_________。
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。