题目内容
(15分)
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。

(1) 写出W的原子结构示意图: 。
(2) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3) 已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式:___________。
(6) 将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。

①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。

(1) 写出W的原子结构示意图: 。
(2) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3) 已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式:___________。
(6) 将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。

①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
(1)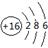 (2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-
(2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-
(3)CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1 (4)2SiO+ 2NaOH Na2SiO3 + Si + H2O
Na2SiO3 + Si + H2O
(5)SO2 -2e-+ 2H2O = SO42-+ 4H+ (6)①Na2S、NaOH ②5 : 3
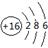 (2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-
(2)AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-(3)CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1 (4)2SiO+ 2NaOH
 Na2SiO3 + Si + H2O
Na2SiO3 + Si + H2O (5)SO2 -2e-+ 2H2O = SO42-+ 4H+ (6)①Na2S、NaOH ②5 : 3
试题分析:根据题意可知这几种元素分别是:X是C;Y是Al;Z是Si;W是S。(1) S的原子结构示意图为
 (2) 将足量CO2的最高价氧化物通入含AlO2-溶液中的反应的离子方程式为AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-.③-①-②×2整理可得CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1(4) ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+ 2NaOH
(2) 将足量CO2的最高价氧化物通入含AlO2-溶液中的反应的离子方程式为AlO2-+ CO2 +2H2O = Al(OH)3↓+ HCO3-.③-①-②×2整理可得CH4(g) =C (s) + 2H2(g);ΔH =+75.5 kJ·mol-1(4) ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+ 2NaOH  Na2SiO3 + Si + H2O(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。该反应的总方程式为2SO2+O2+2H2O=2H2SO4,,该电池负极反应式为SO2 -2e-+ 2H2O = SO42-+ 4H+ 。(6)①在NaOH的溶液中通入H2S,发生的反应:2NaOH+H2S=Na2S+2H2O.若二者恰好反应。则滴加HCl时应该是Na2S+HCl="NaCl+NaHS;" NaHS+HCl=NaCl+H2S↑.前后的盐酸消耗的体积相同。但是由于在开始产生气体时消耗HCl的体积为3,当气体达到最大值时体积为5,说明原固体中含有NaOH和Na2S。即O点溶液中所含溶质的化学式为NaOH和Na2S。②在O点溶液中所含溶质的化学式为NaOH和Na2S,当滴加HCl至完全反应时,根据元素守恒可得n(Na+)= n(Cl-)= 5;而在a至恰好反应还需要HCl的物质的量为2mol,因此在a点时溶液中的n(Cl-)=3.因此在a点溶液中,c(Na+): c(Cl-)= 5 : 3。
Na2SiO3 + Si + H2O(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。该反应的总方程式为2SO2+O2+2H2O=2H2SO4,,该电池负极反应式为SO2 -2e-+ 2H2O = SO42-+ 4H+ 。(6)①在NaOH的溶液中通入H2S,发生的反应:2NaOH+H2S=Na2S+2H2O.若二者恰好反应。则滴加HCl时应该是Na2S+HCl="NaCl+NaHS;" NaHS+HCl=NaCl+H2S↑.前后的盐酸消耗的体积相同。但是由于在开始产生气体时消耗HCl的体积为3,当气体达到最大值时体积为5,说明原固体中含有NaOH和Na2S。即O点溶液中所含溶质的化学式为NaOH和Na2S。②在O点溶液中所含溶质的化学式为NaOH和Na2S,当滴加HCl至完全反应时,根据元素守恒可得n(Na+)= n(Cl-)= 5;而在a至恰好反应还需要HCl的物质的量为2mol,因此在a点时溶液中的n(Cl-)=3.因此在a点溶液中,c(Na+): c(Cl-)= 5 : 3。
练习册系列答案
相关题目


