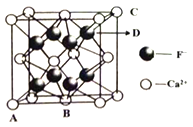
题目内容
【题目】常温时,1mol·L-1的HClO2和1mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法正确的是( )
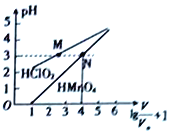
A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=1g![]()
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
【答案】B
【解析】从图像可知,V/V0=1000时,1mol·L-1的HMnO4稀释后的溶液pH=3,所以HMnO4为强酸,HClO2为弱酸;同浓度的两种酸,当pH均为3时,根据物料守恒规律:HMnO4 溶液: c(H+)=c(MnO4-); HClO2溶液: c(H+)= c(ClO2-)+ c(HClO2);根据上述等式看出溶液中c(ClO2-)<c(MnO4-);A错误;酸性:HClO2<HMnO4,同浓度的NaClO2水解显碱性,pH>7,NaMnO4溶液不水解显中性;C错误;两种都为一元弱酸,同体积同浓度中和1mol·L-1的NaOH溶液能力相同,D错误;根据图像可知:因为HMnO4为强酸,满足0≤pH≤5时,溶液的pH 与溶液体积稀释的关系 pH=1g![]() +1-1=1g
+1-1=1g![]() ;C正确;正确答案选C。
;C正确;正确答案选C。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目