题目内容
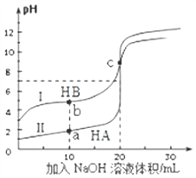
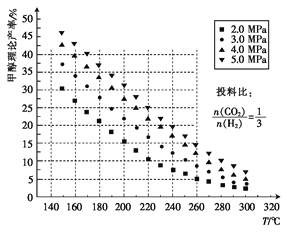
【题目】CO2的固定和利用对降低温室气体排放具有重要作用,CO2加氢合成甲醇不仅可以有效缓解减排压力,而且还是CO2综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。
CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。
(1)下列措施能使CO2的转化率提高的是__。
A. 增大压强 B.升高温度 C.增大投料比 D.加入更高效的催化剂
(2)在220℃、5.0MPa时,CO2、H2的转化率之比为______。
(3)将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将___(填“增大”“减小”或“不变”,下同),CO2的转化率将____。
(4)200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K=___ 。
【答案】 A 1∶1 减小 增大 ![]()
【解析】⑴.A. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的正反应为气体体积减小的反应,增大压强,平衡正向移动,CO2的转化率增大,故A正确;B.据图可知,升高温度,甲醇的产率降低,说明升高温度平衡逆向移动,该反应为放热反应,CO2的转化率减小,故B错误;C.增大
CH3OH(g)+H2O(g)的正反应为气体体积减小的反应,增大压强,平衡正向移动,CO2的转化率增大,故A正确;B.据图可知,升高温度,甲醇的产率降低,说明升高温度平衡逆向移动,该反应为放热反应,CO2的转化率减小,故B错误;C.增大![]() 的投料比,将会提高H2的转化率,CO2的转化率减小,故C错误;D.催化剂只能改变反应速率而不能使平衡发生移动,CO2的转化率不变,故D错误;答案选A;
的投料比,将会提高H2的转化率,CO2的转化率减小,故C错误;D.催化剂只能改变反应速率而不能使平衡发生移动,CO2的转化率不变,故D错误;答案选A;
⑵. 在220℃、5.0MPa时,设起始加入CO2的物质的量为1mol、H2的物质的量为3mol,二者完全反应生成甲醇的物质的量为1mol,现甲醇的理论产率为25%,则甲醇实际生成0.25mol,根据反应方程式可知,消耗CO2的物质的量为0.25mol,消耗H2的物质的量为0.75mol,则CO2和H2的转化率之比为: ![]() ×100%:
×100%:![]() ×100%=1:1,故答案为:1:1;
×100%=1:1,故答案为:1:1;
⑶.降低温度和减小压强都会使化学反应速率减小,观察图象可知,在220℃、5.0MPa时,甲醇的理论产率为25%,在160℃、3.0MPa时,甲醇的理论产率高于25%,则温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,甲醇的理论产率增大,CO2的转化率增大,故答案为:减小;增大;
⑷. 200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡,若CO2的转化率为25%,根据三段式法有:
CO2(g) + 3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 0.1 0.275 0 0
转化浓度(mol/L) 0.025 0.075 0.025 0.025
平衡浓度(mol/L) 0.075 0.2 0.025 0.025
则此温度下该反应的平衡常数K=![]() ,故答案为:K=
,故答案为:K=![]() 1.04。
1.04。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案