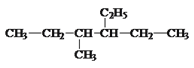题目内容
【题目】图中,A是单质,B的焰色反应呈黄色。判断A、B、C、D的化学式:

A_____ B______ C______ D______
下列转化的化学方程式为:
(1)A→B__________
(2)B→D________
(3)A→C__________
【答案】Na Na2O2 NaOH Na2CO3 2Na+O2![]() Na2O2 2Na2O2+2CO2
Na2O2 2Na2O2+2CO2![]() 2Na2CO3+O2 2Na++2H2O
2Na2CO3+O2 2Na++2H2O![]() 2NaOH+H2↑
2NaOH+H2↑
【解析】
A是一种常见单质,其焰色反应为黄色,则A是Na,B、C、D是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2,Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH,NaOH和CO2反应可以生成Na2CO3,Na2O2和CO2反应也生成Na2CO3,所以D是Na2CO3。
(1)A→B的反应为钠和氧气的反应生成过氧化钠,反应的化学方程式为2Na+O2![]() Na2O2,故答案为:2Na+O2
Na2O2,故答案为:2Na+O2![]() Na2O2;
Na2O2;
(2)B→D的反应为过氧化钠与二氧化碳的反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2![]() 2Na2CO3+O2;
2Na2CO3+O2;
(3)A→C的反应为钠和水的反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O=
2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑。

练习册系列答案
相关题目